2023高三·全国·专题练习
1 . 我国科学家使用了新的铝铍埋藏测年法测量北京猿人的生存年代。这种方法的测量对象是石英(二氧化硅),它是砂石的主要成分。当宇宙射线打到地面时,会将石英中的硅原子和氧原子打破,生成铝和铍的同位素。只要测出一块石头中26Al和10Be的含量,就能推算出它被埋入地下的时间。完成下列填空:
(1)画出Be的核外价电子排布轨道式___________ 。Be所在的周期中,最外层有2个未成对电子的元素的符号是___________ 、___________ 。
(2)写出Al的最外层电子排布式___________ 。铝原子核外有___________ 种运动状态不同的电子;铝原子核外有___________ 种能量不同的电子。有一种与26Al中子数相同的硅的核素,写出该核素符号___________ ,该硅电负性___________ (填“大于”或“小于”)Al 。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序___________ ;这3种元素最高价氧化物对应的水化物中酸性最强的是___________ (写化学式)。
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(1)画出Be的核外价电子排布轨道式
(2)写出Al的最外层电子排布式
(3)比较Al3+、S2-和Cl-半径由大到小的顺序
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
您最近一年使用:0次
解题方法
2 . 三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3)SO2分子的 VSEPR模型名称为_______
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
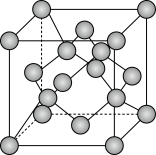
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为_______ cm。
(1)Cr的价电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)SO2分子的 VSEPR模型名称为
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为

您最近一年使用:0次
3 . A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)元素B在周期表中的位置_________________ ,以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)________ ,D、E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)___________ 。
(2)L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为________ 。
(3)CI3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为_____________________ 。
(4)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:___________ 。
(1)元素B在周期表中的位置
(2)L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为
(3)CI3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为
(4)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:
您最近一年使用:0次
解题方法
4 . A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,B与D同周期,R与Q同周期,A与R同主族,D与Q同主族,D元素的原子最外层电子数是次外层电子数的三倍,B元素的最高正价和最低负价代数和为2。请用对应的化学用语回答下列问题:
(1)Q元素位于元素周期表中第______ 周期_____ 族。
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为_______ 。
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为____ 。
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为_______________ ;室温下,向Y溶液中加入一定量的NaOH,使溶液中c(AQD3-)=c(QD32-),则此时溶液呈______ (填“酸性”、“碱性”或“中性”)
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合物中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为______ g。
(1)Q元素位于元素周期表中第
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合物中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
您最近一年使用:0次
5 . 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题:
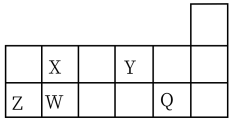
(1)W在周期表中的位置是__________ ,Y、Z的离子半径由大到小的顺序为__________ (用元素符号表示)。
(2)下列说法正确的是__________ 。
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作1:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作II:再加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2=S4O62-+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:
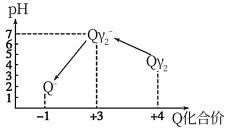
①操作I中反应的离子方程式是___________________ 。
②确定操作Ⅱ完全反应的现象是_________________ 。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_________________ 。
④若水样的体积为1.0 L,在操作Ⅱ中消耗了 l.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是_______ mg.L-1(精确到0.01)。

(1)W在周期表中的位置是
(2)下列说法正确的是
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作1:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作II:再加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2=S4O62-+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:

①操作I中反应的离子方程式是
②确定操作Ⅱ完全反应的现象是
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是
④若水样的体积为1.0 L,在操作Ⅱ中消耗了 l.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是
您最近一年使用:0次
2017-02-17更新
|
1148次组卷
|
3卷引用:2017届天津市五区县高三上学期期末考试化学试卷



