解题方法
1 . W、X、Y、Z、M是五种位于三个不同短周期的主族元素。已知:①X、Y为同主族;②常温下, X、Y、Z、M的最高价氧化物对应水化物的pH如图所示。
X、Y、Z、M的最高价氧化物对应水化物的pH如图所示。

下列说法错误的是
 X、Y、Z、M的最高价氧化物对应水化物的pH如图所示。
X、Y、Z、M的最高价氧化物对应水化物的pH如图所示。
下列说法错误的是
| A.原子半径从大到小的顺序是Y>Z>M>X>W |
| B.W形成的阴离子核外电子排布与氦原子相同 |
| C.X、Y、Z、M的最高价含氧酸都具有强氧化性 |
D.X、Y、Z、M与W均可形成含有 的化合物 的化合物 |
您最近一年使用:0次
2022-09-08更新
|
143次组卷
|
2卷引用:山西省2022-2023学年高三上学期第一次摸底考试化学试题
名校
2 . 原子序数由小到大排列的四种短周期元素 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。
(1)写出 的电子式:
的电子式:___________ 。其中含有的化学键是___________ 。
(2)用电子式表示 的形成过程
的形成过程___________ 。
(3) 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是___________ (填化学式)。
(4) 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是___________ (填化学式)。
(5)由 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式___________ 。
 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。(1)写出
 的电子式:
的电子式:(2)用电子式表示
 的形成过程
的形成过程(3)
 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是(4)
 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是(5)由
 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
您最近一年使用:0次
2022-04-01更新
|
206次组卷
|
13卷引用:2016-2017学年辽宁省庄河高级中学高二上开学测化学试卷
2016-2017学年辽宁省庄河高级中学高二上开学测化学试卷2015-2016学年江西省金溪一中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2018版化学(苏教版)高考总复习专题五课时跟踪训练--微粒之间的相互作用力与物质的多样性山西省运城市康杰中学2017-2018学年高一下学期期中考试化学试题北京四中2017-2018学年高一下学期第二次月考化学试题新疆自治区和田地区和田县喀什塔什乡中学2019届高三年级四月调研考试理综化学试题百所名校联考-必修二模块综合检测黑龙江省哈尔滨市尚志市尚志中学2021届高三10月月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题河南省新野县第一高级中学校2021-2022学年高一下学期第三次考试化学试题四川省成都市树德中学2021-2022学年高一下学期5月阶段性测试化学试题
名校
解题方法
3 . 一种新型漂白剂(如图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是
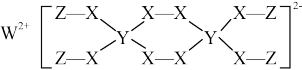

| A.W单质在空气中点燃发出耀眼的白光 |
| B.W、X对应的简单离子半径W>X |
| C.Y的单质高温下可与水反应放出氢气,体现Y的氧化性 |
| D.该漂白剂的漂白原理与SO2相同 |
您最近一年使用:0次
2022-05-21更新
|
213次组卷
|
2卷引用:河南省南阳市第一中学校2022-2023学年高二上学期开学考试化学试题
名校
解题方法
4 . X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4。请回答下列问题:
(1)Y的元素名称是______ 。
(2)W在周期表中的位置是______ 。
(3)写出化合物Z2R的电子式______ 。
(4)写出化合物X2Y2的结构式______ 。
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是______ (用元素的离子符号表示)。
(6)下列说法能证明非金属性Q强于R的是______ (填序号)。
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性: Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是______ 。
(1)Y的元素名称是
(2)W在周期表中的位置是
(3)写出化合物Z2R的电子式
(4)写出化合物X2Y2的结构式
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是
(6)下列说法能证明非金属性Q强于R的是
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性: Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是
您最近一年使用:0次
2021-01-19更新
|
592次组卷
|
5卷引用:湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)
名校
5 . 某新型漂白剂(结构如下)可用于漂白各种动物皮毛,其中W、Y、Z为不同周期且不同主族的短周期主族元素,W、X对应的简单离子核外电子排布相同。下列叙述正确的是


| A.原子半径W>X>Y>Z |
| B.W、Z形成的化合物具有很强的氧化性 |
| C.X的简单氢化物是同主族元素简单氢化物中沸点最高的 |
| D.工业上冶炼W采用电解W和X形成的化合物的熔融态 |
您最近一年使用:0次
名校
解题方法
6 . 元素 R、X、T、Z、Q 在元素周期表中的相对位置如图所示,其中 R 的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是
| R | ||
| X | T | Z |
| Q |
| A.气态氢化物的酸性:R>T>Q |
| B.气态氢化物的还原性:X>T |
| C.R 与 Q 的电子数相差 16 |
| D.R 的单质通入 T 的钠盐溶液中能置换出T 的单质 |
您最近一年使用:0次
2020-05-08更新
|
153次组卷
|
3卷引用:四川省内江市第六中学2019-2020学年高一下学期入学考试化学A试题
名校
解题方法
7 . 前四周期主族元素V、W、X和Y,原子序数依次增大且最外层电子数之和为11,元素V的一种核素可用于文物断代,W的气态氢化物和其最高价氧化物的水化物能形成离子化合物,X是短周期原子半径最大的原子。下列说法正确的是:
| A.简单离子半径大小:r(W) < r(X ) < r(Y) |
| B.X与氧能形成两种只含离子键的化合物 |
| C.最高价氧化物对应水化物碱性:X > Y |
| D.简单氢化物的稳定性:W > V |
您最近一年使用:0次
8 . 短周期元素 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 的原子在元素周期表中半径最小;
的原子在元素周期表中半径最小; 的次外层电子数是其最外层电子数的
的次外层电子数是其最外层电子数的 ;
; 的单质可与冷水剧烈反应,产生
的单质可与冷水剧烈反应,产生 的单质;
的单质; 与
与 属于同一主族。下列叙述正确的是
属于同一主族。下列叙述正确的是
 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 的原子在元素周期表中半径最小;
的原子在元素周期表中半径最小; 的次外层电子数是其最外层电子数的
的次外层电子数是其最外层电子数的 ;
; 的单质可与冷水剧烈反应,产生
的单质可与冷水剧烈反应,产生 的单质;
的单质; 与
与 属于同一主族。下列叙述正确的是
属于同一主族。下列叙述正确的是A. 元素形成的简单离子与 元素形成的简单离子与 元素形成的简单离子的核外电子总数相同 元素形成的简单离子的核外电子总数相同 |
B.单质的氧化性: |
C.化合物 、 、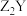 、 、 中化学键的类型完全相同 中化学键的类型完全相同 |
D.原子半径: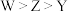 |
您最近一年使用:0次
2020-09-06更新
|
871次组卷
|
4卷引用:云南省昆明市四川师范大学昆明实验学校安宁校区2020-2021学年高一下学期开学考试化学试题
云南省昆明市四川师范大学昆明实验学校安宁校区2020-2021学年高一下学期开学考试化学试题人教版(2019)高一必修第一册第四章 物质结构 元素周期律 素养拓展区高一必修第一册(苏教2019版)专题5 素养拓展区(已下线)第15练 第四章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)
名校
解题方法
9 . 现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为________ 、E是________ (填元素名称)。
(2)D的单质分子的结构式_______ ,C元素最高价氧化物的水化物的电子式____ 。
(3)写出工业上冶炼B单质的化学方程式_______________ 。
(4)写出CD的溶液中通入氯气的离子方程式________________ 。
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性_________ 。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为
(2)D的单质分子的结构式
(3)写出工业上冶炼B单质的化学方程式
(4)写出CD的溶液中通入氯气的离子方程式
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性
您最近一年使用:0次
2020-05-19更新
|
129次组卷
|
3卷引用:四川省仁寿第一中学校南校区2020-2021学年高一下学期开学考试化学试题
名校
解题方法
10 . 现有七种短周期主族元素,其原子序数按A、B、C、D、E、F、G的顺序递增。A元素的最高正化合价和最低负化合价的代数和等于0,且A的氧化物能够造成温室效应;A、B、C三种元素都能形成10电子分子,且C与F位于同一主族;D与C可形成离子化合物DC;E的简单阳离子是同周期元素所形成的简单离子中半径最小的。回答下列问题:
(1)B位于周期表第______ 周期第______ 族。
(2)请写出B的氢化物可能的电子式_________ 、_________ 。
(3)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为__________ (用化学式表示)。
(4)A的单质与F的最高价氧化物的水化物浓溶液反应的化学方程式为:_________ 。
(5)A、M、F、G的最高价氧化物对应水化物的酸性由强到弱的顺序为__________ (用化学式表示)。
(6)下列实验方法能证明D与E的金属性强弱关系的是____ (填字母序号)。
A.比较D和E的单质分别与等浓度的稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物的价态
D.比较D和E最高价氧化物的水化物的碱性强弱
(7)4 mol D 单质与含有10 mol B的最价氧化物的水化物溶液恰好完全,则含有B元素的还原产物可能是_______ 、_________ (写出化学式)。
(1)B位于周期表第
(2)请写出B的氢化物可能的电子式
(3)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为
(4)A的单质与F的最高价氧化物的水化物浓溶液反应的化学方程式为:
(5)A、M、F、G的最高价氧化物对应水化物的酸性由强到弱的顺序为
(6)下列实验方法能证明D与E的金属性强弱关系的是
A.比较D和E的单质分别与等浓度的稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物的价态
D.比较D和E最高价氧化物的水化物的碱性强弱
(7)4 mol D 单质与含有10 mol B的最价氧化物的水化物溶液恰好完全,则含有B元素的还原产物可能是
您最近一年使用:0次



