解题方法
1 . 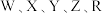 为短周期主族元素,原子序数依次增大。
为短周期主族元素,原子序数依次增大。 元素最外层电子数是次外层电子数的2倍;
元素最外层电子数是次外层电子数的2倍; 的阴离子和
的阴离子和 的阳离子与氖原子的电子层结构相同;常温下,
的阳离子与氖原子的电子层结构相同;常温下, 的单质是气体,
的单质是气体,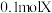 的气体与足量的氢气完全反应共有
的气体与足量的氢气完全反应共有 电子转移;
电子转移; 的单质在点燃时与
的单质在点燃时与 的单质充分反应,生成淡黄色固体,此淡黄色固体能与化合物
的单质充分反应,生成淡黄色固体,此淡黄色固体能与化合物 反应生成
反应生成 的单质;
的单质; 与
与 同族,
同族, 的气态氢化物能与其最高价含氧酸的浓溶液发生氧化还原反应。回答下列问题:
的气态氢化物能与其最高价含氧酸的浓溶液发生氧化还原反应。回答下列问题:
(1)在元素周期表中,W位于___________ 族,属于___________ 区。X、Y、R三种元素的简单离子的离子半径由小到大顺序为___________ (用离子符号表示)。
(2)X和Z的简单氢化物中,沸点更高的是___________ (填化学式),这是因为___________ 。
(3)Z元素在周期表的位置为___________ ,其非金属性比R弱,下列表述能证明这一事实的有___________ (填标号)。
A.常温下Z的单质和R的单质状态不同
B.R的简单氢化物比Z的简单氢化物稳定
C.一定条件下Z和R的单质都能与钠反应
D.Z的最高价含氧酸的酸性弱于R的最高价含氧酸
E.R的单质能与Z的简单氢化物反应生成Z的单质
(4)Z元素的低价氧化物与R单质的水溶液反应的离子方程式为___________ 。经测定 形成的氢化物
形成的氢化物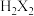 为二元弱酸,其酸性比碳酸弱,实验室常用稀硫酸处理
为二元弱酸,其酸性比碳酸弱,实验室常用稀硫酸处理 来制备
来制备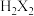 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
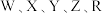 为短周期主族元素,原子序数依次增大。
为短周期主族元素,原子序数依次增大。 元素最外层电子数是次外层电子数的2倍;
元素最外层电子数是次外层电子数的2倍; 的阴离子和
的阴离子和 的阳离子与氖原子的电子层结构相同;常温下,
的阳离子与氖原子的电子层结构相同;常温下, 的单质是气体,
的单质是气体,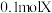 的气体与足量的氢气完全反应共有
的气体与足量的氢气完全反应共有 电子转移;
电子转移; 的单质在点燃时与
的单质在点燃时与 的单质充分反应,生成淡黄色固体,此淡黄色固体能与化合物
的单质充分反应,生成淡黄色固体,此淡黄色固体能与化合物 反应生成
反应生成 的单质;
的单质; 与
与 同族,
同族, 的气态氢化物能与其最高价含氧酸的浓溶液发生氧化还原反应。回答下列问题:
的气态氢化物能与其最高价含氧酸的浓溶液发生氧化还原反应。回答下列问题:(1)在元素周期表中,W位于
(2)X和Z的简单氢化物中,沸点更高的是
(3)Z元素在周期表的位置为
A.常温下Z的单质和R的单质状态不同
B.R的简单氢化物比Z的简单氢化物稳定
C.一定条件下Z和R的单质都能与钠反应
D.Z的最高价含氧酸的酸性弱于R的最高价含氧酸
E.R的单质能与Z的简单氢化物反应生成Z的单质
(4)Z元素的低价氧化物与R单质的水溶液反应的离子方程式为
 形成的氢化物
形成的氢化物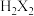 为二元弱酸,其酸性比碳酸弱,实验室常用稀硫酸处理
为二元弱酸,其酸性比碳酸弱,实验室常用稀硫酸处理 来制备
来制备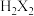 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
2 . 元素周期表是学习化学的基础,如图为元素周期表的一部分。
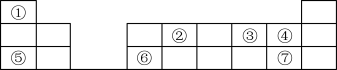
回答下列问题:
(1)④的简单离子结构示意图为_______ 。
(2)⑦在元素周期表中的位置是_______ 。
(3)②的最简单氢化物的空间结构为_______ 。
(4)⑤、⑥两种元素的最高价氧化物对应的水化物反应离子方程式为_______ 。
(5)①和⑤形成的化合物中化学键类型为_______ ;③和⑤形成的淡黄色固体为_______ (填化学式),该化合物与 反应的化学方程式为
反应的化学方程式为_______ 。
(6)欲比较③与④的非金属性强弱,下列说法可作为判断依据的是_______ (填字母)。
a.比较③、④两种元素单质的沸点高低
b.比较③、④两种元素单质与 化合的难易程度
化合的难易程度
c.比较③、④两种元素气态氢化物的稳定性
d.比较③、④两种元素的氧化物对应水化物的酸性强弱

回答下列问题:
(1)④的简单离子结构示意图为
(2)⑦在元素周期表中的位置是
(3)②的最简单氢化物的空间结构为
(4)⑤、⑥两种元素的最高价氧化物对应的水化物反应离子方程式为
(5)①和⑤形成的化合物中化学键类型为
 反应的化学方程式为
反应的化学方程式为(6)欲比较③与④的非金属性强弱,下列说法可作为判断依据的是
a.比较③、④两种元素单质的沸点高低
b.比较③、④两种元素单质与
 化合的难易程度
化合的难易程度c.比较③、④两种元素气态氢化物的稳定性
d.比较③、④两种元素的氧化物对应水化物的酸性强弱
您最近一年使用:0次
2023-03-06更新
|
41次组卷
|
2卷引用:甘肃省武威市天祝一中、古浪一中、民勤一中联考2022-2023学年高一下学期3月月考化学试题
3 . R、W、X、Y、Z是原子序数依次增大的前四周期元素,其中R与W位于同一周期,且R元素的第一电离能大于氧,W的单质在暗处与 能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:
能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:
(1)基态Z原子的价层电子排布式为__________ ,该元素位于元素周期表中的__________ 区。
(2)基态R原子中有__________ 个未成对电子,其中能量最高的电子所在原子轨道的电子云轮廓图为__________ 形。
(3)R、W、X三种元素中第一电离能由大到小的顺序为____ (用元素符号表示),原因是________ 。
(4)R、W、X、Y、Z中非金属元素形成的最简单气态氢化物的稳定性由强到弱的顺序是__________ (填化学式)。
(5)X、Y两种元素组成的化合物 的电子式为
的电子式为__________ ,其中含有的化学键类型为__________ 。
 能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:
能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:(1)基态Z原子的价层电子排布式为
(2)基态R原子中有
(3)R、W、X三种元素中第一电离能由大到小的顺序为
(4)R、W、X、Y、Z中非金属元素形成的最简单气态氢化物的稳定性由强到弱的顺序是
(5)X、Y两种元素组成的化合物
 的电子式为
的电子式为
您最近一年使用:0次
2023-02-15更新
|
169次组卷
|
2卷引用:甘肃省白银市会宁县第四中学2023-2024学年高三上学期第三次月考化学试题
名校
4 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
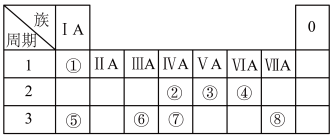
(1)地壳中含量居于第二位的元素在周期表中的位置是_______ 。
(2)用电子式表示②的最高价氧化物的形成过程为_______ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:_______ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是_______ (填字母)。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为_______ 。
②铯单质与H2O反应的化学反应方程式为_______ 。
③预测铯单质的还原性比钠单质的还原性_______ (填“弱”或“强”)。
④下列推断正确的是_______ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为_______ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)用电子式表示②的最高价氧化物的形成过程为
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知Cs元素位于元素周期表中第六周期第IA族,请回答下列问题:
①铯的原子序数为
②铯单质与H2O反应的化学反应方程式为
③预测铯单质的还原性比钠单质的还原性
④下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
5 . 有X、Y、Z、M、R、Q六种短周期的主族元素,部分信息如下表所示:
请回答下列问题:
(1)R在元素周期表中的位置是___________
(2)根据表中数据推测,Y的原子半径的最小范围是___________
(3)Z、M、Q的简单离子的半径由大到小的顺序为___________ (用离子符号表示)
(4)由元素X、M、Q组成的化合物属于___________ 化合物。写出Z2M2的电子式___________
(5)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是___________ (选填字母序号)
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性:XR>YX4
C.Y与R形成的化合物中Y呈正价
D.酸性HR>H2XO3
(6)写出R的单质与Z的最高价氧化物对应水化物的水溶液反应的离子方程式___________
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.160 | ||
| 主要化合价 | -4、+ 4 | -2 | -1、+ 7 | |||
| 其它信息 | 某种核素无中子 | 常用的半导体材料 | 短周期主族元素中原子半径最大 | 次外层电子数是最外层电子数的4倍 |
(1)R在元素周期表中的位置是
(2)根据表中数据推测,Y的原子半径的最小范围是
(3)Z、M、Q的简单离子的半径由大到小的顺序为
(4)由元素X、M、Q组成的化合物属于
(5)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性:XR>YX4
C.Y与R形成的化合物中Y呈正价
D.酸性HR>H2XO3
(6)写出R的单质与Z的最高价氧化物对应水化物的水溶液反应的离子方程式
您最近一年使用:0次
2021-06-01更新
|
1260次组卷
|
6卷引用:甘肃省民乐县第一中学2020-2021学年高一下学期期中考试化学试题
6 . 有四种短周期元素,相关信息如下表。
请根据表中信息回答:
(1)用电子式表示B与C形成化合物的过程:___________ 。
(2)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)___________ 。
(3)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是___________ 。
a.其单质在常温下呈固态 b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3 d.非金属性比S元素的强
| 元素 | 相关信息 |
| A | 气态氢化物极易溶于水,可用作制冷剂 |
| B | 单质的焰色反应为黄色 |
| C | 单质是黄绿色气体,可用于自来水消毒 |
| D | –2价阴离子的电子层结构与Ar原子相同 |
(1)用电子式表示B与C形成化合物的过程:
(2)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)
(3)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是
a.其单质在常温下呈固态 b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3 d.非金属性比S元素的强
您最近一年使用:0次
解题方法
7 . 现有下列短周期元素性质的数据:
已知元素⑧最高价氧化物对应的水化物能溶于盐酸和氢氧化钠溶液。试回答下列问题:
(1)上述元素中处于第ⅠA族的有__ ,处于第3周期的有___ (以上均用编号表示)。
(2)元素④与元素⑦相比较,气态氢化物较稳定的是__ (填气态氢化物的化学式)。
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式__ 。
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(1)上述元素中处于第ⅠA族的有
(2)元素④与元素⑦相比较,气态氢化物较稳定的是
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式
您最近一年使用:0次
解题方法
8 . A、B、C、D均是短周期元素,A和B同周期,B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2,A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成离子化合物D2A或D2A2。请回答
(1)写出元素符号B:___ ;C:___ 。
(2)BA2的结构式___ ,BA2分子中化学键属于___ 键。
(3)D2A2的电子式___ ,D2A2中化学键属于___ 键。
(4)C在元素周期表中的位置是___ ,其原子结构示意图___ 。
(5)电子式表示化合物D2A的形成过程:___ 。
(1)写出元素符号B:
(2)BA2的结构式
(3)D2A2的电子式
(4)C在元素周期表中的位置是
(5)电子式表示化合物D2A的形成过程:
您最近一年使用:0次
解题方法
9 . 六种主族元素A、B、C、D、X、Y的原子序数依次增大,且均小于54。常温下A2B呈液态,高纯度的单质C具有良好的半导体性能。D、X、Y原子核外最外层电子数均为7,过渡元素Z与B可形成多种化合物,其中红棕色粉末Z2B3常用作外墙涂料。请完成下列空白。
(1)将D2水溶液滴入浅绿色的ZD2溶液中,发生反应的离子方程式为___ 。
①甲认为X2和Y2都可能将Z2+氧化为Z3+,他推理的依据是___ 。
②乙认为X2和Y2都不能将Z2+氧化为Z3+;丙认为X2能将Z2+氧化为Z3+而Y2不能。乙、丙推理的依据是__ 。
(2)A与B可形成既含极性键又含非极性键的化合物W。W的水溶液呈弱酸性,常用作无公害的消毒杀菌剂等。W的电子式为__ 。
(3)铅(Pb)、锡(Sn)、锗(Ge)与元素C位于同主族,原子核外电子层数均小于7;常温下,锡、锗在空气中不反应,而铅表面会生成一层氧化铅。锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为__ ;
②它们+4价氢氧化物的碱性由强到弱顺序为__ (填化学式)。
(1)将D2水溶液滴入浅绿色的ZD2溶液中,发生反应的离子方程式为
①甲认为X2和Y2都可能将Z2+氧化为Z3+,他推理的依据是
②乙认为X2和Y2都不能将Z2+氧化为Z3+;丙认为X2能将Z2+氧化为Z3+而Y2不能。乙、丙推理的依据是
(2)A与B可形成既含极性键又含非极性键的化合物W。W的水溶液呈弱酸性,常用作无公害的消毒杀菌剂等。W的电子式为
(3)铅(Pb)、锡(Sn)、锗(Ge)与元素C位于同主族,原子核外电子层数均小于7;常温下,锡、锗在空气中不反应,而铅表面会生成一层氧化铅。锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为
②它们+4价氢氧化物的碱性由强到弱顺序为
您最近一年使用:0次
名校
解题方法
10 . W、X、Y、Z 是原子序数依次增大的四种短周期元素。W 的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,W、X、Y、Z 的最外层电子数之和为 16。回答下列问题:
(1)Z 单质的电子式是__ 。W的气态氢化物能使紫色石蕊溶液变蓝的原因__ (用化学方程式表示)。
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是____ (用离子符号表示)。
(3)不能能证明Z的非金属性比W强的实验事实是____ (填字母)。
A.HZ的稳定性比WH3的稳定性性强
B.Z2与H2化合比W2与H2化合容易
C.HZ的水溶液酸性比WH3的水溶液酸性强
D.Z的最高价氧化物对应水化物的酸性比W强
(4)Z和氧元素、硫元素组成的SOZ2是一种液态化合物,沸点为77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。请写出SOZ2和水反应的化学方程式_ 。
(5) Y和Z两元素形成化合物中化学键的类型为____ 。
(6)用电子式表示X2O的形成过程____ 。
(7)砷(As)与W位于同一主族,下列推断正确的是_____ (填序号)。
①砷元素的最低负化合价为−3价
②砷的最高价氧化物对应的水化物属于酸
③热稳定性:AsH3>NH3
(1)Z 单质的电子式是
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是
(3)不能能证明Z的非金属性比W强的实验事实是
A.HZ的稳定性比WH3的稳定性性强
B.Z2与H2化合比W2与H2化合容易
C.HZ的水溶液酸性比WH3的水溶液酸性强
D.Z的最高价氧化物对应水化物的酸性比W强
(4)Z和氧元素、硫元素组成的SOZ2是一种液态化合物,沸点为77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。请写出SOZ2和水反应的化学方程式
(5) Y和Z两元素形成化合物中化学键的类型为
(6)用电子式表示X2O的形成过程
(7)砷(As)与W位于同一主族,下列推断正确的是
①砷元素的最低负化合价为−3价
②砷的最高价氧化物对应的水化物属于酸
③热稳定性:AsH3>NH3
您最近一年使用:0次



