18-19高一下·湖北荆州·阶段练习
1 . 下表是元素周期表的一部分,针对表中的①〜⑩种元素,填写下列空白:
(1)上述元素中,形成化合物种类最多的是______ (填元素符号)。
(2)元素①、④和⑤形成的化合物的电子式是______ ,该化合物中存在的化学键类型是______ 。
(3)②、③、⑦三种元素原子半径由大到小的顺序是______ (用元素符号表示)。
⑤、⑥、⑦、⑧、⑨、⑩六种元素形成的简单离子,半径最小的是_________ ,最大的是___________ (填离子符号)。
(4)⑤、⑥、⑦三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是______ (用对应物质的化学式表示)。
(5)最易形成离子键的两种元素代号是_____________ 。
(6)能比较元素⑨和⑩非金属性强弱的实验事实是______ (填字母序号)。
a.⑨的氢化物的酸性比⑩的氢化物的酸性弱
b.⑩的单质R2与H2化合比⑨的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑨的氢化物H2Q的水溶液中通少量⑩的单质R2气体可置换出单质Q
| 周期 | IA | IIA | ⅢA | IVA | VA | VIA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①、④和⑤形成的化合物的电子式是
(3)②、③、⑦三种元素原子半径由大到小的顺序是
⑤、⑥、⑦、⑧、⑨、⑩六种元素形成的简单离子,半径最小的是
(4)⑤、⑥、⑦三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是
(5)最易形成离子键的两种元素代号是
(6)能比较元素⑨和⑩非金属性强弱的实验事实是
a.⑨的氢化物的酸性比⑩的氢化物的酸性弱
b.⑩的单质R2与H2化合比⑨的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑨的氢化物H2Q的水溶液中通少量⑩的单质R2气体可置换出单质Q
您最近一年使用:0次
2019-03-27更新
|
943次组卷
|
3卷引用:【南昌新东方】莲塘一中 2019-2020 学年高一年级 4 月网络考试化学
(已下线)【南昌新东方】莲塘一中 2019-2020 学年高一年级 4 月网络考试化学湖北省荆州中学、宜昌一中等三校2018-2019学年高一下学期3月联考化学试题人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 章末综合检测卷
名校
2 . 有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大,已知A的L层电子数是K层电子数的两倍,D是短周期元素中原子半径最大的元素,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A___________ ;B___________ ;E___________ ;
(2)B、C、D、E的原子半径由小到大的顺序为(用元素符号或化学式表示,以下同)___________ ,D2C2的电子式___________ ,所含化学键___________ 。
(3)写出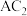 与
与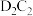 反应的化学方程式
反应的化学方程式___________ 。
(4)C、E的简单氢化物的沸点较高的是___________ ,原因是___________ 。
(5)用电子式表示化合物AC2的形成过程___________ 。
(1)元素名称:A
(2)B、C、D、E的原子半径由小到大的顺序为(用元素符号或化学式表示,以下同)
(3)写出
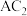 与
与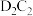 反应的化学方程式
反应的化学方程式(4)C、E的简单氢化物的沸点较高的是
(5)用电子式表示化合物AC2的形成过程
您最近一年使用:0次
名校
解题方法
3 . 有A、B、C、D、E、F、G7种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素
(1)A的名称是____ ,B位于周期表中第____ 周期____ 族,C的原子结构示意图是________________ 。
(2)E的单质颜色是_______ 。
(3)A元素与D元素形成的化合物的电子式是_________ 。
(4)G的单质与水反应的化学方程式是________ 。
(5)F的元素符号是__________ 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是_____ (填化学式,下同),酸性最强的是_______ ,气态氢化物最稳定的是__________ 。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是_______________ 。
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素
(1)A的名称是
(2)E的单质颜色是
(3)A元素与D元素形成的化合物的电子式是
(4)G的单质与水反应的化学方程式是
(5)F的元素符号是
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
您最近一年使用:0次
2017-04-25更新
|
1867次组卷
|
4卷引用:江西省南昌市八一中学、洪都中学、麻丘中学、十七中、桑海中学2016-2017学年高一下学期期中考试化学试题
4 . 下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
(1)11种元素中,化学性质最不活泼的是___________ ,原子半径最小的是___________ 。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是___________ 。
(3)②③④中形成的简单离子半径由大到小的顺序是___________ 。
(4)元素⑦的氢化物电子式为___________ ,该氢化物常温下和元素②的单质反应的离子方程式是___________ 。
(5)①和⑨的最高价氧化物对应的水化物化学式为___________ 和___________ 。①和⑨两元素形成化合物中化学键的类型为___________ 该化合物的溶液与元素⑧的单质反应的离子方程式为___________ 。
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为___________ 。
(7)⑧⑨⑪三种元素形成的气态氢化物最稳定的是___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是
(3)②③④中形成的简单离子半径由大到小的顺序是
(4)元素⑦的氢化物电子式为
(5)①和⑨的最高价氧化物对应的水化物化学式为
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(7)⑧⑨⑪三种元素形成的气态氢化物最稳定的是
您最近一年使用:0次
名校
解题方法
5 . 位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是自然界中含量最高的金属。根据你的推断完成下列问题:
(1)E元素在周期表中的位置为_______ 。
(2)写出由上述元素形成的具有漂白作用的三种物质的化学式_______ 。
(3)用电子式表示C与D形成化合物的过程_______ 。
(4)写出E的最高价氧化物与强碱反应的离子方程式________ 。
(5)B、C两元素形成的原子个数比为1:1的化合物中的化学键为______ 。
(1)E元素在周期表中的位置为
(2)写出由上述元素形成的具有漂白作用的三种物质的化学式
(3)用电子式表示C与D形成化合物的过程
(4)写出E的最高价氧化物与强碱反应的离子方程式
(5)B、C两元素形成的原子个数比为1:1的化合物中的化学键为
您最近一年使用:0次
名校
6 . 下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
(1)元素⑩在周期表中的位置是___________ ,⑦的原子结构示意图为___________ 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为___________ (用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是___________ (用名称表示),最高价氧化物对应水化物中,酸性最强的是___________ (用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式___________ 。
(5)下列五种物质中,①H2O ②CO2 ③Na2O2 ④NaOH ⑤NaBr,
只存在共价键的是___________ ,只存在离子键的是___________ ,既存在离子键又存在共价键的是___________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
| ⑩ |
(2)④、⑤、⑥的简单离子半径由大到小的顺序为
(3)④⑧⑨的气态氢化物中,最稳定的是
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式
(5)下列五种物质中,①H2O ②CO2 ③Na2O2 ④NaOH ⑤NaBr,
只存在共价键的是
您最近一年使用:0次
2011·江西·二模
7 . 已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
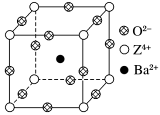
(1) Y在周期表中位于______________ ;Z4+的核外电子排布式为___________________ 。
(2)X的该种氢化物分子构型为________ ,X在该氢化物中以_______ 方式杂化。X和Y形成的化合物的熔点应该_______ (填“高于”或“低于”)X的氢化物的熔点。
(3)①制备M的化学方程式是_____________ 。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________ 。
③在M晶体中,Z4+的氧配位数为________ 。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。

(1) Y在周期表中位于
(2)X的该种氢化物分子构型为
(3)①制备M的化学方程式是
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的
③在M晶体中,Z4+的氧配位数为
④已知O2-半径为1.40×10-10 m,则Z4+半径为
您最近一年使用:0次
2016-12-09更新
|
1125次组卷
|
5卷引用:2011届江西省重点中学协作体高三第二次联考(理综)化学部分
(已下线)2011届江西省重点中学协作体高三第二次联考(理综)化学部分苏教版2017届高三单元精练检测十一化学试题黑龙江省齐齐哈尔市第八中学2017-2018学年高二6月月考化学试题山东省章丘市第四中学2019届高三上学期第二次质量检测理综化学试题新疆奎屯市第一高级中学2018-2019学年高二下学期第一次月考化学试题
名校
解题方法
8 . 如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
(1)写出元素符号:A____ ;C_____ 。
(2)B的最高价氧化物对应水化物的化学式为____ 。
(3)A的单质的电子式为___ ;A的氢化物的水溶液与其最高价氧化物的水化物反应的化学方程式____ 。

(1)写出元素符号:A
(2)B的最高价氧化物对应水化物的化学式为
(3)A的单质的电子式为
您最近一年使用:0次
2017-07-13更新
|
278次组卷
|
3卷引用:江西省鄱阳县第二中学2018-2019学年高一下学期期中考试化学试题
名校
9 . 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外最外层共有24个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同
回答下列问题:
(1) A与E形成的化合物的化学式是__________ .B的最高价氧化物化学式为_____________ ,
(2)D的单质与水反应的方程式为__________________________________________________ .
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是___________________ :有关反应的离子方程式为:_____________________________________ .
回答下列问题:
(1) A与E形成的化合物的化学式是
(2)D的单质与水反应的方程式为
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
您最近一年使用:0次
2019-04-22更新
|
111次组卷
|
2卷引用:江西省新余市分宜中学2018-2019学年高一下学期第二次段考化学试题
解题方法
10 . A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第________ 周期第________ 族。
(2)E元素形成的氧化物对应的水化物的化学式为____________________ 。
(3)元素C、D、E形成的简单离子半径大小关系是______ >______ >_____ (用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:____________________ 。C、D还可形成化合物D2C2,D2C2中含有的化学键是________________________ 。
(1)B在周期表中的位置为第
(2)E元素形成的氧化物对应的水化物的化学式为
(3)元素C、D、E形成的简单离子半径大小关系是
(4)用电子式表示化合物D2C的形成过程:
您最近一年使用:0次



