1 . 回答下列问题:
(1)已知离子R2—的原子核内有n个中子。R原子的质量数为m,则W克离子R2—含有的电子的物质的量为____ 。
(2)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为:XY2(液)+3O2(气)=XO2(气)+2YO2(气)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g·L-1,则:
①反应前O2在标况下的体积是___ 。
②化合物XY2的摩尔质量是___ 。
③若XY2分子中X、Y两元素的质量之比为3∶16,则X元素是___ 。(写元素符号)
(3)30g重水(D2O)中所含中子数与___ g水(H2O)所含的中子数相等。
(1)已知离子R2—的原子核内有n个中子。R原子的质量数为m,则W克离子R2—含有的电子的物质的量为
(2)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为:XY2(液)+3O2(气)=XO2(气)+2YO2(气)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g·L-1,则:
①反应前O2在标况下的体积是
②化合物XY2的摩尔质量是
③若XY2分子中X、Y两元素的质量之比为3∶16,则X元素是
(3)30g重水(D2O)中所含中子数与
您最近一年使用:0次
解题方法
2 . 下列关于化学用语的表述正确的是
A.BF3的电子式: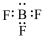 | B.Fe2+的原子结构示意图: |
C.中子数为143的U原子: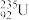 | D.乙醇的结构简式:C2H6O |
您最近一年使用:0次
2020-12-24更新
|
947次组卷
|
2卷引用:山东省聊城市2021届高三上学期期中考试化学试题
3 . 设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A.NA个H2O分子中,含有10NA个电子 |
| B.常温下,14gC2H4和C3H6混合气体所含的原子数为3NA |
| C.7.8gNa2O2中含有的阴离子数为0.1NA |
| D.4.6gNa与含0.1molHCl的稀盐酸充分反应,转移电子数目为0.1NA |
您最近一年使用:0次
解题方法
4 . 自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(l)2016年IUPAC确认了四种新元素,其中一种为Mc,中文为“镆”。元素Mc可由反应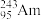 +
+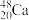 →288Mc+3
→288Mc+3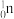 得到。该元素的质子数为
得到。该元素的质子数为_______ ,287Mc与288Mc互为________ 。
(2)Mc位于元素周期表中第VA族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式__________ ,该分子内存在的共价键类型有_________ 。
(3)该族中的另一元素P能呈现多种化合价,其中+3价氧化物的分子式为_________ ,该氧化物对应的水化物为H3PO3,已知该酸与足量NaOH溶液反应所得产物化学式为Na2HPO3,则Na2HPO3是________ (填“正盐”或“酸式盐”)。
(l)2016年IUPAC确认了四种新元素,其中一种为Mc,中文为“镆”。元素Mc可由反应
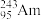 +
+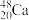 →288Mc+3
→288Mc+3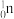 得到。该元素的质子数为
得到。该元素的质子数为(2)Mc位于元素周期表中第VA族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式
(3)该族中的另一元素P能呈现多种化合价,其中+3价氧化物的分子式为
您最近一年使用:0次
5 . 铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
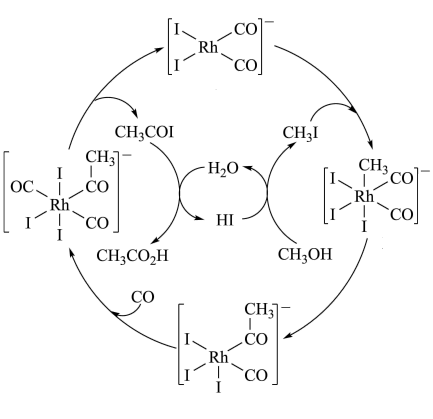
| A.CH3COI是反应中间体 |
| B.甲醇羰基化反应为CH3OH+CO=CH3CO2H |
| C.反应过程中Rh的成键数目保持不变 |
| D.存在反应CH3OH+HI=CH3I+H2O |
您最近一年使用:0次
2020-07-08更新
|
17476次组卷
|
48卷引用:2020年全国统一考试化学试题(新课标Ⅰ)
2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编(已下线)第13讲 原子结构和化学键-2021年高考化学一轮复习名师精讲练河南省郑州市巩义市第四高级中学2021届高三上学期期中考试化学试题(已下线)小题必刷21 原子结构与化学键——2021年高考化学一轮复习小题必刷(通用版)2020年全国卷Ⅰ理综化学高考真题变式题(已下线)热点10 新信息反应机理分析-2021年高考化学专练【热点·重点·难点】(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)热点7 新信息反应机理分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)天津市和平区2020-2021学年高二下学期期末考试化学试题(已下线)课时27 微粒间作用力-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点38 烃的含氧衍生物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点38 卤代烃 醇 酚-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点39 醛 羧酸 酯-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷08 元素周期律-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)安徽省合肥市普通高中六校联盟2021-2022学年高二下学期期中联考化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏加德罗常数-备战2022年高考化学临考题号押题(全国卷)(已下线)查补易混易错点01 物质的组成、性质、分类及化学用语-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题07化学反应中的能量变化及反应机理-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题07化学反应中的能量变化及反应机理-五年(2018~2022)高考真题汇编(全国卷)北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)专题1 揭示物质结构的奥秘 ★第一~三单元综合拔高练四川省内江市第六中学2021-2022学年高二下学期入学考试(创新班)化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省大庆市东风中学2022-2023学年高三上学期第一次月考化学试题河南省洛阳市新安县第一高级中学2022-2023学年高三上学期入学测试(实验小班)化学试题湖南省邵阳市洞口县第一中学2021-2022学年高三下学期第三次模拟考试化学试题北京市中国人民大学附属中学2022-2023学年高三上学期统练6化学试题(已下线)广东省深圳中学2023届高三年级上学期第二次阶段测试化学试题(A卷)黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻3 化学反应历程图像分析内蒙古赤峰二中2022-2023学年高二下学期第一次月考化学试题广东省2021届高三下学期模拟预热化学试题(已下线)专题10 物质的反应及转化(已下线)热点题型训练 催化剂与反应历程(机理)广东省汕头市金山中学2023-2024学年高二上学期10月阶段考试 化学 Word版含答案(已下线)T12-物质反应及转化江苏省南京市人民中学 海安实验中学 句容三中2023-2024学年高二下学期3月月考化学试题
名校
6 . NA为阿伏加 德罗常数的值。下列有关叙述正确的是
| A.107 g Fe(OH)3胶体中胶体粒子的数目为NA |
| B.1 L 0.1 mol·L-1Na2CO3溶液中CO32-和HCO3-的离子数之和为0.1NA |
| C.常温常压下,3.6 g D2O与H218O中含有中子数2NA |
| D.30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA |
您最近一年使用:0次
名校
7 . 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构。关于A、B、C、D四种元素的叙述正确的是( )
| A.原子序数a>b>c>d |
| B.原子半径 B>A>C>D |
| C.单质还原性A>B>C>D |
| D.离子半径D(n+1)->Cn->An+>B(n+1)+ |
您最近一年使用:0次
2019-06-20更新
|
899次组卷
|
3卷引用:河北省石家庄市正定县第七中学2018-2019学年高一下学期3月月考化学试题
河北省石家庄市正定县第七中学2018-2019学年高一下学期3月月考化学试题(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记新疆维吾尔自治区乌鲁木齐市第一中学2021--2022学年高一上学期期末考试化学试题
名校
8 . 已知元素X,Y的核电荷数分别为a和b,它们的离子Xn+的Ym-的核外电子排布完全相同,则下列关系中正确的是 ( )
| A.a+m=b-n | B.a+b=m+n | C.a-m=b+n | D.a+m=b-n |
您最近一年使用:0次
9 . 蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________ (用元素符号表示);
(2)N3-的立体构型是___________ 形:与N3-互为等电子体的一种分子是___________ (填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________ ;SO42-中的硫原子杂化方式为___________ ;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________ 。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____ 体图形;与Te原子距离最近的Te原子有___ 个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____ g/cm3。
(已知相对原子质量:Zn-65、Te-128)
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为
(2)N3-的立体构型是
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成
(已知相对原子质量:Zn-65、Te-128)

您最近一年使用:0次
2019-02-21更新
|
851次组卷
|
2卷引用:【校级联考】江西省临川一中,南昌二中,九江一中,新余一中等九校重点中学协作体2019届高三上学期第一次联考理科综合化学试题
11-12高一下·四川成都·阶段练习
解题方法
10 . 某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX分子中含质子的物质的量是( )
A.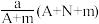 mol mol | B.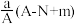 mol mol |
C.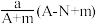 mol mol | D.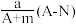 mol mol |
您最近一年使用:0次



