名校
解题方法
1 . 人类对物质微观结构的探索从未停歇,随着科学技术的发展,新的发现将继续揭开开原子更深层次结构的奥秘.
(1)原子结构模型的演变顺序正确的是
①道尔顿模型 ②有核模型 ③葡萄干面包模型 ④电子云模型 ⑤玻尔模型
(2)第一位通过实验证明原子可以再分的科学家是
(3)卢瑟福团队用 粒子
粒子 来轰击金箔,该化学符号中4代表的含义是①
来轰击金箔,该化学符号中4代表的含义是①_____________ ;在1~18号元素中,最外层电子数与氦原子相等的元素是②_____________ (填元素符号)。
(4)氦元素在自然界中仅有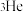 和
和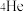 两种原子,它们具有相同的
两种原子,它们具有相同的
(5)当用 粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是
粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是
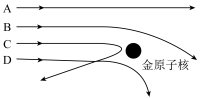
(6)关于 粒子散射实验现象的记载如下:①________的
粒子散射实验现象的记载如下:①________的 粒子都直接穿过金箔,②______的
粒子都直接穿过金箔,②______的 粒子发生偏转,③ 的
粒子发生偏转,③ 的 粒子甚至被直接反弹回去.①②③三处空格分别为
粒子甚至被直接反弹回去.①②③三处空格分别为
(7)通过该试验,卢瑟福得出了原子结构的_____________ 模型。
(8)2022年诺贝尔化学奖授予三位在“点击化学和生物正交化学”方面作出突出贡献的科学家.点击化学的核心理念是,通过小单元的简便拼接,快速可靠地完成各种各样分子的化学合成.在点击化学中,反应快速发生,而且不会产生副产物.下列有关点击化学说法错误的是
(1)原子结构模型的演变顺序正确的是
①道尔顿模型 ②有核模型 ③葡萄干面包模型 ④电子云模型 ⑤玻尔模型
| A.①③②⑤④ | B.①②③④⑤ | C.①⑤③②④ | D.①③⑤④② |
(2)第一位通过实验证明原子可以再分的科学家是
| A.德谟克利特 | B.道尔顿 | C.汤姆孙 | D.卢瑟福 |
(3)卢瑟福团队用
 粒子
粒子 来轰击金箔,该化学符号中4代表的含义是①
来轰击金箔,该化学符号中4代表的含义是①(4)氦元素在自然界中仅有
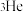 和
和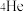 两种原子,它们具有相同的
两种原子,它们具有相同的 | A.质子数 | B.中子数 | C.物理性质 | D.化学性质 |
(5)当用
 粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是
粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是 
| A.A | B.B | C.C | D.D |
(6)关于
 粒子散射实验现象的记载如下:①________的
粒子散射实验现象的记载如下:①________的 粒子都直接穿过金箔,②______的
粒子都直接穿过金箔,②______的 粒子发生偏转,③ 的
粒子发生偏转,③ 的 粒子甚至被直接反弹回去.①②③三处空格分别为
粒子甚至被直接反弹回去.①②③三处空格分别为 | A.绝大多数,极少数,个别 | B.个别,极少数,绝大多数 |
| C.几乎半数,几乎半数,个别 | D.个别,几乎半数,几乎半数 |
(7)通过该试验,卢瑟福得出了原子结构的
(8)2022年诺贝尔化学奖授予三位在“点击化学和生物正交化学”方面作出突出贡献的科学家.点击化学的核心理念是,通过小单元的简便拼接,快速可靠地完成各种各样分子的化学合成.在点击化学中,反应快速发生,而且不会产生副产物.下列有关点击化学说法错误的是
| A.点击化学的反应中会出现新的分子 | B.点击化学的反应中会出现新的原子 |
| C.点击化学能提高反应的准确性 | D.点击化学在生物医疗领域有广泛的应用前景 |
您最近半年使用:0次
名校
解题方法
2 . 研究物质的微观结构和元素组成,并用恰当的化学用语进行表达,能帮助我们揭示物质变化的本质,发现物质变化的规律。
(1)下图是部分元素原子或离子的结构示意图.请你仔细观察、分析,用序号填空:
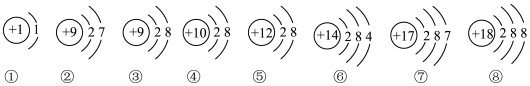
①上述粒子中,属于稀有气体元素的原子是_____________ ;
②在化学反应中容易得到电子的是_____________ ;
③属于正离子的是_____________ ;
④表示 的是
的是_____________ ;
⑤属于同一种元素的是_____________ ;
⑥属于非金属元素的是_____________ ;
⑦电子层数相同、最外层电子数也相同的粒子有_____________ .
(2)卤族元素F和 具有相似的化学性质,其原因是它们的原子具有相同的
具有相似的化学性质,其原因是它们的原子具有相同的
(3)写出铝离子的结构示意图①_____________ ,其核外能量最高的电子层符号为②___________ 。
(4)两种微粒的电子数相同,质子数不同,则它们可能是
①两种不同的原子;②两种不同的离子;③同一种元素的原子和离子;④不同元素的原子和离子
(5)在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与 层相同,当它作为原子的次外层时,其电子数比
层相同,当它作为原子的次外层时,其电子数比 层最少能多10个,则此电子层是
层最少能多10个,则此电子层是
(6)一瓶气体经分析只含一种元素,则该气体
(7)下列物质变化过程不会破坏化学键的是
(8)下列关于化学键的说法正确的是
(9) 的电子式是
的电子式是_____________ 。
(10)请用电子式表示 的形成过程
的形成过程_____________ 。
(1)下图是部分元素原子或离子的结构示意图.请你仔细观察、分析,用序号填空:

①上述粒子中,属于稀有气体元素的原子是
②在化学反应中容易得到电子的是
③属于正离子的是
④表示
 的是
的是⑤属于同一种元素的是
⑥属于非金属元素的是
⑦电子层数相同、最外层电子数也相同的粒子有
(2)卤族元素F和
 具有相似的化学性质,其原因是它们的原子具有相同的
具有相似的化学性质,其原因是它们的原子具有相同的 | A.电子层数 | B.核外电子数 | C.最外层电子数 | D.原子半径 |
(3)写出铝离子的结构示意图①
(4)两种微粒的电子数相同,质子数不同,则它们可能是
①两种不同的原子;②两种不同的离子;③同一种元素的原子和离子;④不同元素的原子和离子
| A.①和④ | B.②和③ | C.①和③ | D.②和④ |
(5)在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与
 层相同,当它作为原子的次外层时,其电子数比
层相同,当它作为原子的次外层时,其电子数比 层最少能多10个,则此电子层是
层最少能多10个,则此电子层是 | A.K层 | B.M层 | C.L层 | D.N层 |
(6)一瓶气体经分析只含一种元素,则该气体
| A.一定是单质 | B.可能是化合物 |
| C.可能是几种单质的混合物 | D.可能是化合物与单质的混合物 |
(7)下列物质变化过程不会破坏化学键的是
| A.水气化为水蒸气 | B.水蒸气在高温下分解为氢气和氧气 |
| C.氯化钠溶于水 | D.氯化钠熔化 |
(8)下列关于化学键的说法正确的是
| A.破坏化学键会放出能量 | B.所有物质中都存在化学键 |
| C.金属元素和非金属元素间一定形成离子键 | D.离子化合物中不一定含有金属元素 |
(9)
 的电子式是
的电子式是(10)请用电子式表示
 的形成过程
的形成过程
您最近半年使用:0次
解题方法
3 . 下面是部分元素原子或离子的结构示意图。请你仔细观察、分析,然后回答问题:
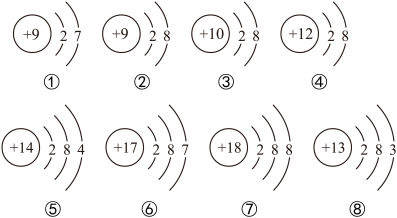
(1)上述微粒中属于同种元素的是_______ (填序号,下同),属于阳离子的是_______ ,属于原子的是_______ 。
(2)电子层数相同,最外层电子数也相同的微粒有_______ 。
(3)属于稀有气体元素的有_______ 。
(4)通过上图还可总结出原子和离子的一些区别,请写出其中两个:_______ 、_______

(1)上述微粒中属于同种元素的是
(2)电子层数相同,最外层电子数也相同的微粒有
(3)属于稀有气体元素的有
(4)通过上图还可总结出原子和离子的一些区别,请写出其中两个:
您最近半年使用:0次
4 . 硅是地壳中含量第二大的元素,其单质是一种重要的半导体材料。
(1)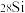 是硅的一种同位素,其原子核内质子数为
是硅的一种同位素,其原子核内质子数为_______ ,Si原子的电子式为_______ 。Si与C的化学性质相似,由此猜想二者在原子结构上的相似之处是_______ 。
(2)如图中,“28.09”的含义是指_______ 。
(3)硅元素在自然界中通常以石英石( )和硅酸盐的形式存在。已知
)和硅酸盐的形式存在。已知 是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式
是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式_______ 。0.1mol的硅酸根离子( )中含有质子
)中含有质子_______ mol,电子_______ 个。
(4)高纯硅单质可由石英砂(主要成分是SiO2)制得,制备高纯硅的主要工艺流程如图所示:

i.硅元素有无定形硅和晶体硅两种单质,他们互为_______ ;
ii.流程①焦炭体现了_______ (填“氧化性”或“还原性”)。
iii.流程④的化学反应为置换反应,写出其化学方程式:_______ 。
(1)
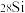 是硅的一种同位素,其原子核内质子数为
是硅的一种同位素,其原子核内质子数为(2)如图中,“28.09”的含义是指
| 14 Si 硅 28.09 |
 )和硅酸盐的形式存在。已知
)和硅酸盐的形式存在。已知 是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式
是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式 )中含有质子
)中含有质子(4)高纯硅单质可由石英砂(主要成分是SiO2)制得,制备高纯硅的主要工艺流程如图所示:

i.硅元素有无定形硅和晶体硅两种单质,他们互为
ii.流程①焦炭体现了
iii.流程④的化学反应为置换反应,写出其化学方程式:
您最近半年使用:0次
名校
解题方法
5 . 构成物质的微观粒子----------原子、 分子和离子,世界是由物质组成的,物质是由极其微小的、肉眼看不见的微粒如原子、分子、离子等构成的。
(1)分子:
i.分子是_______ 的一种微粒。大部分物质是由分子构成的,如苯由苯分子构成,二氧化碳由CO2分子构成等。
分子是由原子构成的,原子的种类和数目不同构成了不同的分子。
ii.分子可用化学式表示,化学式是_______ 的式子。 如水可用H2O表示。
(2)原子:
i.原子是_______ 中的最小微粒。原子又是由_______ 和_______ 构成的。
ii.构成物质 的微粒体积都_______ ,质量也_______ 。
iii.原子可用_______ 表示, 如氢原子可用_______ 表示。
分子和原子的比较:
离子:原子得到或失去电子后形成的带电微粒,如Cl-是由氯原子得到1个电子形成的,Na+是由钠原子失去1个电子后形成的。氯化钠就是由钠离子和氯离子构成的。
(1)分子:
i.分子是
分子是由原子构成的,原子的种类和数目不同构成了不同的分子。
ii.分子可用化学式表示,化学式是
(2)原子:
i.原子是
ii.构成物质 的微粒体积都
iii.原子可用
分子和原子的比较:
离子:原子得到或失去电子后形成的带电微粒,如Cl-是由氯原子得到1个电子形成的,Na+是由钠原子失去1个电子后形成的。氯化钠就是由钠离子和氯离子构成的。
| 分子 | 原子 | ||
| 不同点 | 在化学反应中的情况 | 是保持物质化学性质的最小粒子,在化学反应中可分成原子 | 是化学反应中的最小粒子 |
由什么构成 | 由原子构成 | 由质子、中子和核外电子构成 | |
| 种类数 | 目前已超过3千万种 | 目前已发现100多种元素的原子,绝大多数元素有同位素 | |
| 相同点 | 都是很小的,肉眼看不见的构成物质的粒子,都在不停地运动 | ||
您最近半年使用:0次
名校
6 . 镁是地壳矿物质的重要组成部分,也是我们日常饮食中不可或缺的营养元素。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_______ (填标号)。

(2)人体营养所需的是Mg2+,“试镁灵”是检验化合物中是否含Mg2+的试剂,其结构简式如图所示,其组成元素中电负性由大到小的顺序为_______ (用元素符号表示),分子中N原子的杂化类型为_______ 。
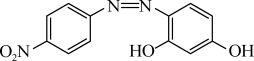
(3)北京大学与美国华盛顿大学、密歇根州立大学等机构的研究人员携手,创造出了迄今世界上最轻的镁原子—— Mg。下列对其描述正确的是_______。
Mg。下列对其描述正确的是_______。
(4)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为_______ 。
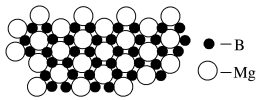
(5)镁与硅形成的晶体的晶胞属于面心立方结构,其晶胞结构如图所示,晶胞参数为anm。
①X点的Mg原子坐标参数为_______ 。
②设NA为阿伏加德罗常数的值,则该晶胞的密度为_______ g·cm-3。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是

(2)人体营养所需的是Mg2+,“试镁灵”是检验化合物中是否含Mg2+的试剂,其结构简式如图所示,其组成元素中电负性由大到小的顺序为
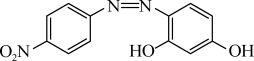
(3)北京大学与美国华盛顿大学、密歇根州立大学等机构的研究人员携手,创造出了迄今世界上最轻的镁原子——
 Mg。下列对其描述正确的是_______。
Mg。下列对其描述正确的是_______。| A.电子数为12 |
| B.相对原子质量为18 |
| C.质子数和中子数之差为6 |
D.与 Mg为同素异形体 Mg为同素异形体 |

(5)镁与硅形成的晶体的晶胞属于面心立方结构,其晶胞结构如图所示,晶胞参数为anm。

①X点的Mg原子坐标参数为
②设NA为阿伏加德罗常数的值,则该晶胞的密度为
您最近半年使用:0次
7 . 下面是元素周期表的一部分,按要求回答下列问题:
(1)已知⑥号元素的一种核素的中子数为8,则其最简单的气态氢化物的摩尔质量为___________  。
。
(2)非金属性最强的单质与水反应的化学方程式为___________ 。
(3)某元素的最高价氧化物的水化物既能与强酸反应又能与强碱反应,该元素的元素符号是___________ ,向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH溶液至过量,现象为___________ 。
(4)设计实验方案;比较⑧与⑪单质氧化性的强弱,请将方案填入下表。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑪ |
 。
。(2)非金属性最强的单质与水反应的化学方程式为
(3)某元素的最高价氧化物的水化物既能与强酸反应又能与强碱反应,该元素的元素符号是
(4)设计实验方案;比较⑧与⑪单质氧化性的强弱,请将方案填入下表。
| 实验步骤 | 实验现象 | 实验结论 |
您最近半年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)相同物质的量的14C18O2与32S16O2的原子数之比为_______ ,中子数之比为_______ ,电子数之比为_______ 。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为_______ (填代号)。
(3)利用元素周期律可预测陌生元素及物质的性质,已知Rb与Na处于同一主族,下列说法正确的是_______。
(1)相同物质的量的14C18O2与32S16O2的原子数之比为
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为_______ (填代号)。
A. | B. | C. | D.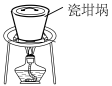 |
| A.失电子能力: Rb>Na |
| B.碱性: NaOH>RbOH |
| C.Rb比Na更易与氧气发生反应 |
| D.Rb不易与水反应放出H2 |
您最近半年使用:0次
名校
9 . 某微粒A的结构示意图如下:
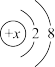
(1)若X=8,则此阴离子与图中带一个正电荷的阳离子形成一种常见化合物的化学式是_______ 。
(2)1mol微粒A含有10mol电子,下列微粒各1mol,也含有10mol电子的有:_______ (填序号)
①CH4②H2O2③HF④Al3+⑤Cl-⑥
(3)若A的阳离子为An+且质量数为a,则其质子数为_______ ,中子数为_______ (用含有a,n的代数式表达)
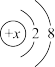
(1)若X=8,则此阴离子与图中带一个正电荷的阳离子形成一种常见化合物的化学式是
(2)1mol微粒A含有10mol电子,下列微粒各1mol,也含有10mol电子的有:
①CH4②H2O2③HF④Al3+⑤Cl-⑥

(3)若A的阳离子为An+且质量数为a,则其质子数为
您最近半年使用:0次
名校
10 . A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。11.5gA单质恰好与100mL5mol/L的盐酸完全反应,反应后溶液呈中性。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。
请回答下列问题:
(1)写出D的元素符号___________ ,E的最高价氧化物的水化物的分子式___________ 。
(2)若构成F元素的一种原子的质量数为35,写出其原子符号___________ ,它原子核内的中子数是___________ 。
(3)A与C元素最高价氧化物的水化物反应的离子方程式为___________ 。
请回答下列问题:
(1)写出D的元素符号
(2)若构成F元素的一种原子的质量数为35,写出其原子符号
(3)A与C元素最高价氧化物的水化物反应的离子方程式为
您最近半年使用:0次



