1 . 地壳中含量排在前五位的元素分别是O、Si、Al、Fe、Ca,占到地壳总质量的90.83%。回答下列问题:
(1)Ca元素的基态原子价电子排布式为
(2)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5]SO4。
溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5]SO4。
① 中N元素采取
中N元素采取
②[Fe(NO)(H2O)5]SO4中含有的作用力类型有
a.离子键 b.金属键 c.配位键 d.极性键 e.非极性键
③[Fe(NO)(H2O)5]SO4中一种配体实际上是NO+,则其中Fe元素的化合价为
(3)硅酸盐中的硅酸根通常以[SiO4]四面体(如图a)的方式形成链状、环状或网络状复杂阴离子。图b为一种环状硅酸根离子,写出其化学式

(4)冰有十六种晶型。自然界中最常见的冰是冰-Ⅰ(如图c),0℃时密度为0.92g·cm-3,其中水分子的配位数为

(1)G元素为
(2)液态化合物Y与稀H2SO4酸化的K2Cr2O7溶液作用可产生一种无色助燃性气体及可溶性的Cr2(SO4)3,则该反应的离子方程式为
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X。写出该反应的化学方程式为
(1)CaO2中含有的化学键类型是
(2)实验室用纯净的CaCO3与H2O2制取过氧化钙的实验步骤如下:
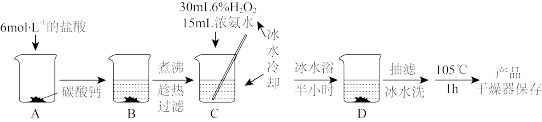
①烧杯A中发生反应的离子方程式为
②过滤时用到的玻璃仪器除烧杯外,还有
③用冰水冷却烧杯C的目的是
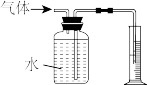
(3)为测定产品中CaO2的质量分数,取m g样品,在温度高于350℃时使之充分分解,并将产生的气体(恢复至标准状况)通过下图所示装置,收集到水的体积为V mL,则产品CaO2的质量分数为
(1)硫代硫酸钠做除氧剂的主要原因是其具有
(2)硫代硫酸钠中所含化学键的类型为
(3)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是
(4)硫代硫酸钠溶液呈弱碱性。用离子方程式解释其呈弱碱性的原因
(5)工业生产中,一般将Na2S和Na2CO3以物质的量比2 :1配成混合溶液,在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,再将SO2缓缓通入溶液中,即可得硫代硫酸钠。
①将蒸馏水加热煮沸一段时间后待用,其目的是
②反应的化学方程式为
③已知:2Na2S2O3+I2= 2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L的碘水进行多次取样滴定,测得Na2S2O3·5H2O 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是
(1)A、B、D 的元素名称分别为
(2)C 在元素周期表中位置为
(3)A、C、D 能组成多种不同的化合物,这些化合物中既含有极性共价键又含有离子键的化合物为
(4)A 和 D 能组成一种化学活性很高的离子化合物 DA,DA 能和C的单质 C2反应生成一种强碱,请写出 DA 和 C2反应的化学方程式



