2023高三·全国·专题练习
解题方法
1 . 铁、钛、镁等金属及其化合物有广泛用途。回答下列问题:
(1)基态Ti原子的价层电子排布图是_______ ,基态Fe原子共有_______ 种不同能级的电子。
(2)某含钛半夹心结构催化剂R能催化乙烯、丙烯等的聚合,其结构如图所示:
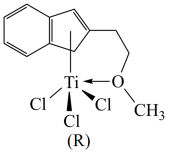
①组成R的元素中,电负性最大的是_______ (填元素符号),氧原子的杂化方式是_______ 。
②R中含有的化学键有_______ (填字母)。
A. 键 B.
键 B. 键 C.离子键 D.配位键 E.金属键
键 C.离子键 D.配位键 E.金属键
(1)基态Ti原子的价层电子排布图是
(2)某含钛半夹心结构催化剂R能催化乙烯、丙烯等的聚合,其结构如图所示:

①组成R的元素中,电负性最大的是
②R中含有的化学键有
A.
 键 B.
键 B. 键 C.离子键 D.配位键 E.金属键
键 C.离子键 D.配位键 E.金属键
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。W、X、Y、Z分别为______________ 。


您最近一年使用:0次
解题方法
3 . 有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。A、B、C、D、E五种元素的电负性分别为2.1,3.5,1.5,2.5,0.8,请回答下列问题:
(1)A是_______ ,B是_______ ,C是_______ ,D是_______ ,E是_______ (用化学符号填空,下同)。
(2)由电负性判断,以上五种元素中金属性最强的是_______ ,非金属性最强的是_______ 。
(3)当B与A、C、D分别形成化合物时,B显_______ 价(填“正”或“负”或“零”,下同),其他元素显_______ 价。
(4)当B与A、C、D、E(与E形成E2B)分别形成化合物时,化合物中有离子键的是_______ (填化学式)。
(1)A是
(2)由电负性判断,以上五种元素中金属性最强的是
(3)当B与A、C、D分别形成化合物时,B显
(4)当B与A、C、D、E(与E形成E2B)分别形成化合物时,化合物中有离子键的是
您最近一年使用:0次
名校
4 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W的最简单氢化物甲是一种能使湿润的红色石蕊试纸变蓝的无色气体,常用作制冷剂,Y的金属性是所有短周期主族元素中最强的,Z与X属于同一主族,Z与Y属于同一周期。
(1)元素W在周期表位置_______ ;
(2)元素W的另一常见氢化物乙是一种高能燃料,为18电子微粒,乙的结构式_______ ;
(3)X、Y、Z的原子半径由小到大为_______ ;
(4)若X与Z的最外层电子数之和是W核外电子数的2倍,甲可与Z单质发生置换反应,产物之一可作化肥,其反应的化学方程式为_______ 该产物化肥中含有的化学键有_______ 。
(5)若由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。则元素Z是_______ 元素,反应的离子方程式为_______
(1)元素W在周期表位置
(2)元素W的另一常见氢化物乙是一种高能燃料,为18电子微粒,乙的结构式
(3)X、Y、Z的原子半径由小到大为
(4)若X与Z的最外层电子数之和是W核外电子数的2倍,甲可与Z单质发生置换反应,产物之一可作化肥,其反应的化学方程式为
(5)若由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。则元素Z是
您最近一年使用:0次
名校
解题方法
5 . X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。Y在同周期中原子半径最大,W与X同主族,能形成WX3化合物。已知Z是金属,其氧化物和氢氧化物均显两性。
(1)元素Z在元素周期表中的位置为__ ,Y、Z、W、Q的离子半径从大到小顺序为__ (用离子符号表示)。
(2)Y2X2的电子式为__ ,其化学键类型为__ 。
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为__ ;其最高价氧化物对应的水化物的化学式为__ ,其酸性比硫酸___ (填“强”或“弱”)。
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式__ 。
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式__ 。
(1)元素Z在元素周期表中的位置为
(2)Y2X2的电子式为
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式
您最近一年使用:0次
2022-01-05更新
|
80次组卷
|
2卷引用:山西省运城市新绛中学校2022届高三10月月考化学试题
名校
解题方法
6 . 自然界中存在一种天然硅铝酸盐,它们具有筛选分子、吸附、离子交换和催化作用。这种天然物质称为沸石,人工合成的沸石也被称为分子筛。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.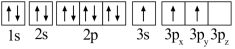 B.
B.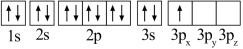
C.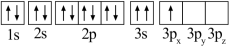 D.
D.
其中能量最低的是_____ (填字母),状态A中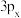 的电子云轮廓图为
的电子云轮廓图为_____ ,状态C电子排布图有错误,主要不符合_____ 。
(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为_____ (填字母),该化合物阴离子的空间构型是___________ 。
A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为___________ ,0.5mol丙烯中含___________ mol 键。
键。
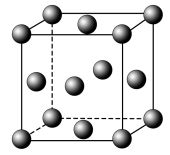
(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为___________ ,铝原子的半径为___________ nm(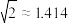 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为___________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
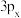 的电子云轮廓图为
的电子云轮廓图为(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在
 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为
 键。
键。(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为
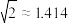 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为 (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
您最近一年使用:0次
2021-12-30更新
|
182次组卷
|
3卷引用:辽宁省名校2021-2022学年高三上学期第五次联合考试化学试题
7 . 高纯碳酸锰是人工合成脂肪酸时的催化剂,也可用作分析试剂、媒染剂、添加剂、药用辅料等。工业上可由软锰矿(主要成分为MnO2,含少量的Fe3O4、Al2O3、SiO2)与硫化锰(MnS)矿石制备高纯碳酸锰(MnCO3),其工艺流程如图所示:

25℃时相关物质的Ksp数据见下表:
回答下列问题:
(1)软锰矿、MnS矿石预先粉碎的目的是___________ 。H2SO4中含有的化学键的类型为___________ (填标号)。
a.离子键 b.非极性共价键 c.极性共价键
(2)“滤渣1”中含有S和___________ (填化学式),“溶浸”时二氧化锰与硫化锰反应的化学方程式为___________ 。
(3)“氧化”时加入试剂X的目的是___________ 。
(4)“调pH”的目的是___________ 。
(5)“操作1”的名称为___________ ;“操作2”为水洗,其具体操作为___________ 。
(6)“沉锰”时发生反应的离子方程式为___________ 。

25℃时相关物质的Ksp数据见下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)软锰矿、MnS矿石预先粉碎的目的是
a.离子键 b.非极性共价键 c.极性共价键
(2)“滤渣1”中含有S和
(3)“氧化”时加入试剂X的目的是
(4)“调pH”的目的是
(5)“操作1”的名称为
(6)“沉锰”时发生反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 元素周期表第IIIA族包括B、Al、Ga等元素,它们参与形成的化合物有重要研究和应用价值,回答下列问题:
(1)Ga原子的价电子排布式为___________ ;Ga、As和Se的第一电离能由小到大的顺序是___________ 。
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。
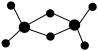
①该分子中Al原子采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有___________ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为___________ 。
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是___________ 。
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的___________ (填“正四面体形” 或“正八面体形”)空隙。已知GaN的密度为ρ g/cm3,Ga和As的摩尔质量分别为a g/mol和b g/mol,则GaN晶胞的边长为___________ pm(列出表达式)。

(1)Ga原子的价电子排布式为
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原子采取
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的

您最近一年使用:0次
20-21高一下·四川广安·阶段练习
解题方法
9 . 如表为元素周期表的一部分,请回答有关问题:
(1)已知第四周期有18种元素,其中元素⑩的一种核素,中子数为45,用原子符号表示该核素为_______ 。
(2)由元素①和④形成的10电子分子的结构式为_______ 。
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程_______ 。
(4)由元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为_______ ,元素④和⑦的简单氢化物沸点较高的是_______ (填化学式),理由是:_______ 。元素⑧和⑩的最高价氧化物对应的水化物酸性较强的是(填化学式)_______ 。
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是_______ (用离子符号表示);元素⑨的最高价氧化物的水化物与元素⑥的最高价氧化物反应的离子方程式为_______ 。
(6)已知NH3•H2O的电离方程式为NH3•H2O NH
NH +OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构
+OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构_______ (填字母代号)。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)由元素①和④形成的10电子分子的结构式为
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程
(4)由元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是
(6)已知NH3•H2O的电离方程式为NH3•H2O
 NH
NH +OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构
+OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构
您最近一年使用:0次
2021-05-20更新
|
336次组卷
|
5卷引用:考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题17 化学键(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省邻水实验学校2020-2021学年高一下学期第二次月考化学试题
10 . 卤族元素的化合物在生活、医药、化工中有着重要的用途。
I.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

(1)氧原子核外有_______ 种运动状态不同的电子;碘原子最外层电子的排布式为_______ ;K2CO3固体中含有的化学键有_______ 。
(2)合成步骤中的化学方程式为_______ 。
(3)当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因:_______ 。
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(4)该反应的氧化产物为_______ ,若反应过程中有4 mol HCl参与反应,则电子转移的数目为_______ 。
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(5)向浓缩的海水中通入Cl2,将海水中的Br-氧化为Br2。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是_______ 。
(6)用热空气将Br2从上述溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2。吸收1 mol Br2需消耗Na2CO3_______ mol。
I.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

(1)氧原子核外有
(2)合成步骤中的化学方程式为
(3)当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因:
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(4)该反应的氧化产物为
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(5)向浓缩的海水中通入Cl2,将海水中的Br-氧化为Br2。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是
(6)用热空气将Br2从上述溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2。吸收1 mol Br2需消耗Na2CO3
您最近一年使用:0次



