名校
1 . X、Y、Z、M、W、Q、R是7种短周期元素,其性质如下:
完成下列填空:
(1)上述元素中,X在周期表中的位置是__ ,由Y、Q形成的简单离子半径大小关系是Y___ Q(填“>”或“<”)。
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为___ ,是18e-分子的有__ 种。
(3)写出证明Z、M非金属性强弱的化学方程式为__ 。
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为___ 。(填选项)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
| 元素代号 | X | Y | Z | M | W | Q | R |
| 原子半径/nm | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | ||
| 主要化合价 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | ||
| 其它 | 焰色为黄色 | 形成气体单质密度最小 |
(1)上述元素中,X在周期表中的位置是
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为
(3)写出证明Z、M非金属性强弱的化学方程式为
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
您最近一年使用:0次
2020-11-14更新
|
149次组卷
|
2卷引用:湖南省衡阳市第一中学2021届高三上学期期中考试化学试题
名校
2 . A、X、Y、Z、R、W为六种短周期元素。A是短周期中半径最小的元素;X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常作耐高温材料。回答下列问题:
(1)Y元素的名称是___________ ,W在周期表中的位置是___________ 。
(2)写出化合物AZX的结构式:___________ ;化合物R2X2存在的化学键类型是___________ 。
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:___________ (用离子符号表示)。
(4)下列事实能证明非金属性Z比Y强的是___________ (填序号)。
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:___________ 。
(6)用电子式表示RZ的形成过程:___________ 。
(1)Y元素的名称是
(2)写出化合物AZX的结构式:
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:
(4)下列事实能证明非金属性Z比Y强的是
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:
(6)用电子式表示RZ的形成过程:
您最近一年使用:0次
2020-12-11更新
|
333次组卷
|
5卷引用:四川省江油中学2021届高三上学期开学考试理综化学试题
名校
解题方法
3 . 电镀废水中常含有剧毒的NaCN,可用两段氧化法处理:
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:NaOCN+NaClO→Na2CO3+CO2↑+NaCl+N2↑(未配平)
完成下列填空:
(1)上述反应涉及的元素Na、N、O中,简单离子半径最小的是___ (填离子符号),氢原子最外层电子的轨道表示式是___ 。
(2)NaCN中所含有的化学键类型是___ ,N2的电子式为___ 。
(3)已知NaOCN中N元素为-3价,配平第二段过程的化学方程式并标出电子转移的方向和数目___ 。
(4)综合两段反应,处理含有0.01molNaCN的废水,至少需NacClO___ mol。
(5)请用一个方程式证明氮元素的非金属性大于碳元素___ 。
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:NaOCN+NaClO→Na2CO3+CO2↑+NaCl+N2↑(未配平)
完成下列填空:
(1)上述反应涉及的元素Na、N、O中,简单离子半径最小的是
(2)NaCN中所含有的化学键类型是
(3)已知NaOCN中N元素为-3价,配平第二段过程的化学方程式并标出电子转移的方向和数目
(4)综合两段反应,处理含有0.01molNaCN的废水,至少需NacClO
(5)请用一个方程式证明氮元素的非金属性大于碳元素
您最近一年使用:0次
解题方法
4 . 掌握物质之间的转化,是学习元素化合物知识的基础。
(I)
(1)中学常见的某反应的化学方程式为:
A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式____________ ;
②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是_________ ,该溶液还可以用_____________ 试剂代替。
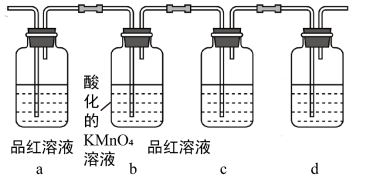
③装置d中所盛溶液是__________ 。
(II)下列框图所示的物质转化关系中,甲、乙、丙是常见的气体单质。气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去)。

请回答下列问题:
(2)写出C的电子式:___________________________ 。
(3)E是_______ 化合物(填“共价”或“离子”,含有的化学键为__________________ 。
(4)写出B和丙生成A的离子反应方程式_________________________________________ 。
(5)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式:
______________________________________________________________________ 。
(I)
(1)中学常见的某反应的化学方程式为:
A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式
②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是

③装置d中所盛溶液是
(II)下列框图所示的物质转化关系中,甲、乙、丙是常见的气体单质。气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去)。

请回答下列问题:
(2)写出C的电子式:
(3)E是
(4)写出B和丙生成A的离子反应方程式
(5)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式:
您最近一年使用:0次
2014高三·全国·专题练习
5 . 四种短周期元素在周期表中的位置如图,其中只有M为金属元素。
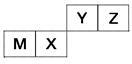
请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是______ (写化学式),该氢化物的电子式为______ 。
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是______ ,列举一个化学方程式证明______ 。
(3)元素Z与元素M组成的化合物中所含化学键类型为______ ,元素Z与元素X组成的化合物中所含化学键类型为______ 。

请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是
(3)元素Z与元素M组成的化合物中所含化学键类型为
您最近一年使用:0次
6 . 国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
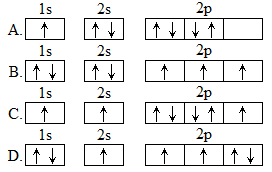
(1)下列氮原子的电子排布图表示的状态中,能量最高的是___________ (填字母标号)。
(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是___________ (填字母标号)。
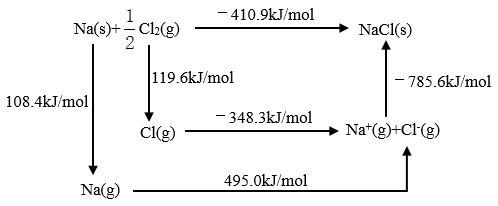
a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为___________ 。
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有___________ (填字母)。
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为___________ (用NA表示阿伏加德罗常数的值)。
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.5g∙cm-3,则CuF的晶胞参数a=___________ nm(列出计算式)。

(1)下列氮原子的电子排布图表示的状态中,能量最高的是

(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次



