名校
1 . 一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图所示。
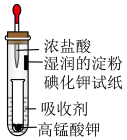
下列说法不正确的是

下列说法不正确的是
| A.吸收剂可以是饱和NaOH溶液 |
| B.湿润的淀粉碘化钾试纸变蓝说明Cl的非金属性强于I |
| C.该实验中浓盐酸体现了还原性和酸性 |
| D.高锰酸钾是共价化合物 |
您最近半年使用:0次
名校
解题方法
2 . 下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式 回答,(5)~(8)小题按题目要求回答。
(1)表中元素,化学性质最不活泼的是___ ,只有负价而无正价的是___ ,氧化性最强的单质是___ ,还原性最强的单质是___ 。
(2)最高价氧化物的水化物中碱性最强的是___ ,酸性最强的是___ ,呈两性的是___ 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___ 。
(4)在B、C、E、F、G、H中,原子半径最大的是___ 。
(5)用电子式表示B和H组成化合物的形成过程___ ,它属于___ 化合物(填“离子”或“共价”)。
(6)写出B的最高价氧化物的水化物和H的单质反应的离子方程式:___ 。
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物中碱性最强的是
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是
(4)在B、C、E、F、G、H中,原子半径最大的是
(5)用电子式表示B和H组成化合物的形成过程
(6)写出B的最高价氧化物的水化物和H的单质反应的离子方程式:
您最近半年使用:0次
2020-03-27更新
|
38次组卷
|
2卷引用:天津市第九十五中学2019-2020学年高一下学期3月检测考试化学试题
名校
解题方法
3 . I.氨气是制备 (叠氮酸钠)的原料之一,汽车安全气囊中的填充物有
(叠氮酸钠)的原料之一,汽车安全气囊中的填充物有 (叠氮酸钠)、
(叠氮酸钠)、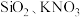 等物质,
等物质, 遇撞击时能生成金属钠和
遇撞击时能生成金属钠和 。
。
(1)下列物质中,既含有氨分子,又含有铵根离子的是_______。
(2) 和
和 的某些化学性质相似,下列对晶体
的某些化学性质相似,下列对晶体 性质的推测,错误的是_______。
性质的推测,错误的是_______。
(3)下列有关化学用语表示正确的是_______。
(4)用电子式表示氨气的形成过程_______ 。
Ⅱ. 是由一种单原子离子和多原子离子以1∶1的比例构成的化合物,结构式为
是由一种单原子离子和多原子离子以1∶1的比例构成的化合物,结构式为 。
。
(5)写出叠氮化钠分解的化学方程式_______ 。
(6)某品牌汽车设计安全气囊受撞击时需产生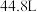 气体(已换算至标准状况下的体积),则该安全气囊中需填充的
气体(已换算至标准状况下的体积),则该安全气囊中需填充的 质量是
质量是_______ g。
(7)汽车安全气囊填充物的三种物质中属于共价化合物的是_______ (填写化学式),所涉及的5种元素中,原子半径最大的是_______ (填写元素符号)。
(8)写出叠氮化钠固体中所含化学键的类型_______ 。
(9)化学键是相邻原子间强烈的相互作用,主要有离子键、共价键等,有关它们叙述正确的_______。
(10)工业通过反应一:
反应二: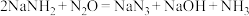
制备 ,下列有关说法中正确的是_______。
,下列有关说法中正确的是_______。
Ⅲ.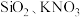 能与分解出的金属钠发生反应生成
能与分解出的金属钠发生反应生成 ,化学方程式为:
,化学方程式为: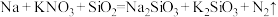 (未配平)。
(未配平)。
(11)在该反应中硝酸钾体现_______ (填写“氧化性”或“还原性”)。
(12)结合金属钠的化学性质,说明汽车安全气囊中填充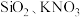 的目的和必要性
的目的和必要性_______ 。
 (叠氮酸钠)的原料之一,汽车安全气囊中的填充物有
(叠氮酸钠)的原料之一,汽车安全气囊中的填充物有 (叠氮酸钠)、
(叠氮酸钠)、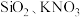 等物质,
等物质, 遇撞击时能生成金属钠和
遇撞击时能生成金属钠和 。
。(1)下列物质中,既含有氨分子,又含有铵根离子的是_______。
| A.氨气 | B.氨水 | C.硝酸 | D.硝酸钾 |
 和
和 的某些化学性质相似,下列对晶体
的某些化学性质相似,下列对晶体 性质的推测,错误的是_______。
性质的推测,错误的是_______。A. 是一种离子化合物 是一种离子化合物 | B. 能与烧碱溶液反应 能与烧碱溶液反应 |
C. 加热后会发生升华 加热后会发生升华 | D. 溶液能与溴水反应 溶液能与溴水反应 |
A. 和 和 的结构示意图均为 的结构示意图均为 | B.氧化钠的分子式: |
C.氨气的空间填充模型: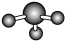 | D.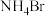 的电子式: 的电子式: |
Ⅱ.
 是由一种单原子离子和多原子离子以1∶1的比例构成的化合物,结构式为
是由一种单原子离子和多原子离子以1∶1的比例构成的化合物,结构式为 。
。(5)写出叠氮化钠分解的化学方程式
(6)某品牌汽车设计安全气囊受撞击时需产生
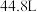 气体(已换算至标准状况下的体积),则该安全气囊中需填充的
气体(已换算至标准状况下的体积),则该安全气囊中需填充的 质量是
质量是(7)汽车安全气囊填充物的三种物质中属于共价化合物的是
(8)写出叠氮化钠固体中所含化学键的类型
(9)化学键是相邻原子间强烈的相互作用,主要有离子键、共价键等,有关它们叙述正确的_______。
| A.非金属元素组成的化合物中只含共价键 |
| B.不同元素的原子构成的分子只含极性共价键 |
| C.熔融状态下能够导电的化合物中存在离子键 |
| D.某纯净物在常温常压下为气体,则组成该物质的微粒一定含共价键 |

反应二:
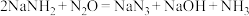
制备
 ,下列有关说法中正确的是_______。
,下列有关说法中正确的是_______。A.反应一每生成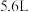 氢气,转移电子数目为 氢气,转移电子数目为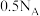 |
B.反应一中 为强电解质、 为强电解质、 为弱电解质 为弱电解质 |
| C.反应二中生成的氨气可以循环利用 |
D.与 同为碱金属叠氮化物的 同为碱金属叠氮化物的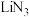 受撞击分解产生 受撞击分解产生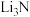 和氮气,反应过程中发生了离子键和共价键的破坏与形成 和氮气,反应过程中发生了离子键和共价键的破坏与形成 |
Ⅲ.
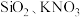 能与分解出的金属钠发生反应生成
能与分解出的金属钠发生反应生成 ,化学方程式为:
,化学方程式为: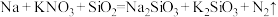 (未配平)。
(未配平)。(11)在该反应中硝酸钾体现
(12)结合金属钠的化学性质,说明汽车安全气囊中填充
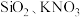 的目的和必要性
的目的和必要性
您最近半年使用:0次
10-11高一下·河北石家庄·期末
4 . 纳米材料二氧化钛(TiO2)可做优良的催化剂。
Ⅰ.工业上二氧化钛的制备方法:
①将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4
②将SiCl4分离,得到纯净的TiCl4
③在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2
(1)根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____ ,分离二者所采取的操作名称是______ 。
(2)③中反应的化学方程式是______ 。
Ⅱ.据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH c. OH+OH→H2O2
(3)b中破坏的是_____ (填“极性共价键”或“非极性共价键”)。
(4)H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的_____ (填“氧化性”或“还原性”)。
Ⅲ.某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)

(5)若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为______ 。
(6)当CO气体全部通入后,还要通一会儿空气,其目的是______ 。
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
①将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4
②将SiCl4分离,得到纯净的TiCl4
③在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2
(1)根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是
(2)③中反应的化学方程式是
Ⅱ.据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH c. OH+OH→H2O2
(3)b中破坏的是
(4)H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的
Ⅲ.某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)

(5)若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为
(6)当CO气体全部通入后,还要通一会儿空气,其目的是
您最近半年使用:0次
解题方法
5 . CsICl2是一种碱金属的化合物,在化学反应中既可表现氧化性又可表现还原性,则下列有关该物质的说法不正确 的是
| A.Cs显+1价 |
| B.向CsICl2溶液中通入Cl2,有单质碘生成 |
| C.CsICl2是离子化合物 |
| D.向酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色 |
您最近半年使用:0次
名校
解题方法
6 . 核外电子排布与化学键。在含有多个电子的原子例,电子的能量不同,根据电子能量的差异,电子应先排布在能量最低的电子层例,然后再依次由里向外排布在能量逐渐升高的电子层例,即分层排布。亨利·莫斯莱和查尔斯·巴克拉的X-射线吸收研究首次与实验中发现电子层。巴克拉把他们称为K、L、M、N(以英文字母排列)等电子层,这些字母后来被n值1、2、3等取代。
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是___________
(2)在1916年,G.N。Lewis在讲述他的化学键理论时提出了电子式,故电子式又被称为路易斯式。根据经典的共价键理论,在形成化合物时,原子核外的单电子要尽可能地进行配对,并达到8电子稳定结构(H为2电子稳定结构)。写出 的电子式:
的电子式:___________ 。
(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是___________
(4)化学键(chemical bond)是纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。常见的化学键有离子键和共价键。离子键是由正离子和负离子之间相互的静电作用力形成的。共价键是由两个或多个原子共同使用他们的外层电子,在理想的情况下达到电子饱和状态,由此组成比较稳定的化学结构。在下列物质中:
①Ar ②SiC ③NaCl ④ ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有___________ (填编号,下同),存在共价键的物质有___________ 。
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是___________
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是
A.硫离子的结构示意图: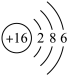 | B.钾原子的结构示意图: |
C.氯离子的电子式: | D.镁离子的电子式: |
 的电子式:
的电子式:(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是
| A.A、B、C都是非金属元素 | B.A、B、C最高价氧化物的水化物均为强酸 |
| C.A、B、C三种核电荷数之和是39 | D.B与A、C均能形成离子化合物 |
①Ar ②SiC ③NaCl ④
 ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是
| 选项 | 性质 | 解释 |
| A | 还原性: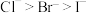 | Cl、Br、I的非金属性依次减弱 |
| B | 沸点: | N的非金属性比P强 |
| C | 分解温度: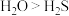 | O的非金属性比S强 |
| D | 酸性: | Cl的非金属比S强 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
7 . 短周期元素A、B、D、E、G、J在周期表中的位置如下:
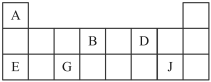
根据上表回答问题:其中(1)~(5)涉及上表推断,(6)~(8)与上表无关。
(1)D在周期表中的位置是_______ 。
(2)A、B、E、G的原子半径由大到小的顺序是___ (填元素符号)。
(3)B的最高价氧化物的电子式为_______ 。
(4)上述六种元素中的二种元素组成的物质中,含有极性键和非极性键的共价化合物是_______ (写结构式),含有非极性键的离子化合物是_______ (写电子式)。
(5)E与G的最高价氧化物对应水化物发生反应的离子 方程式为:_______ 。
(6)下图模型表示均含碳 原子的a、b两种分子,其他原子均为 短周期元素的原子:
a. b.
b.
则a是_______ (写分子式)、b是_______ (写分子式)。
(7)下列关于卤族元素性质的说法,错误 的是_______ (填序号)。
①非金属性:
②氧化性: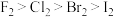
③气态氢化物稳定性:
④氢化物酸性:
⑤氢化物沸点:
⑥氢化物还原性:
⑦四卤化碳 的沸点:
的沸点: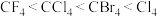
⑧单质的密度: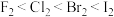
(8)由H、C、N、S四种元素各一个原子可以组成化合物。其中一种分子的结构式为 ,根据每种原子的成键特点,写出另外一种分子的结构式:
,根据每种原子的成键特点,写出另外一种分子的结构式:_______ (分子结构内无环状结构)。

根据上表回答问题:其中(1)~(5)涉及上表推断,(6)~(8)与上表无关。
(1)D在周期表中的位置是
(2)A、B、E、G的原子半径由大到小的顺序是
(3)B的最高价氧化物的电子式为
(4)上述六种元素中的二种元素组成的物质中,含有极性键和非极性键的共价化合物是
(5)E与G的最高价氧化物对应水化物发生反应的
(6)下图模型表示均含
a.
 b.
b.
则a是
(7)下列关于卤族元素性质的说法,
①非金属性:

②氧化性:
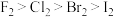
③气态氢化物稳定性:

④氢化物酸性:

⑤氢化物沸点:

⑥氢化物还原性:

⑦四卤化碳
 的沸点:
的沸点: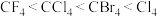
⑧单质的密度:
(8)由H、C、N、S四种元素各一个原子可以组成化合物。其中一种分子的结构式为
 ,根据每种原子的成键特点,写出另外一种分子的结构式:
,根据每种原子的成键特点,写出另外一种分子的结构式:
您最近半年使用:0次
8 . Ⅰ下列化学反应中:
①KClO3+NH4NO2→KCl+NH4NO3(未配平)
②2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
③2F2+2H2O=4HF+O2
④2H2O+Cl2+SO2=H2SO4+2HCl
⑤2KMnO4+16HCl(浓)=2KCl+2MnCl2+5C12↑+8H2O
⑥2KClO3+H2C2O4 +H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
⑦2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是____ (填序号)。
(2)反应①中的氧化剂是____ 。
(3)反应④中氧化产物和还原产物的质量之比为____ ;反应⑤中浓盐酸表现出的性质是____ (填字母)。
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)⑥产生1molClO2时,转移的电子的物质的量为____ mol;1molKClO3参加反应时,生成标准状况下的气体体积为____ L。
Ⅱ.如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
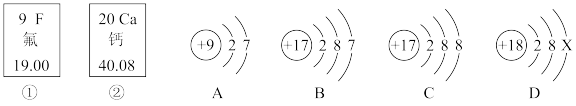
请回答:
(5)钙元素的原子序数为____ ,D中的X为____ ,写出①②两种元素形成的化合物的化学式为____ 。
(6)①②两种元素最本质的区别是____ (填选项)。
a.质子数不同 b.中子数不同 c.相对原子质量不同
(7)②与B形成的二元化合物中的化学键为____ ,HF和HB稳定性强的是____ 。
①KClO3+NH4NO2→KCl+NH4NO3(未配平)
②2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑③2F2+2H2O=4HF+O2
④2H2O+Cl2+SO2=H2SO4+2HCl
⑤2KMnO4+16HCl(浓)=2KCl+2MnCl2+5C12↑+8H2O
⑥2KClO3+H2C2O4 +H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
⑦2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是
(2)反应①中的氧化剂是
(3)反应④中氧化产物和还原产物的质量之比为
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)⑥产生1molClO2时,转移的电子的物质的量为
Ⅱ.如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。

请回答:
(5)钙元素的原子序数为
(6)①②两种元素最本质的区别是
a.质子数不同 b.中子数不同 c.相对原子质量不同
(7)②与B形成的二元化合物中的化学键为
您最近半年使用:0次
9 . A、B、C、D为核电荷数依次增大的前三周期主族元素,A和C同族,B和D同族,B的简单离子和C的简单离子具有相同的电子层结构,A和B、D均能形成共价化合物,A和B、C分别形成的化合物溶于水均呈碱性。下列说法中错误的 是
| A.4种元素中C的金属性最强 |
| B.简单阳离子氧化性:A>C |
| C.A和C形成的化合物与水反应能生成一种还原性气体 |
| D.最高价氧化物对应的水化物的酸性:D>B |
您最近半年使用:0次
解题方法
10 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素的相关知识回答下列问题。
(1)按原子序数递增的顺序(稀有气体元素除外),下列说法正确的是____________ (填标号)。
a.原子半径和离子半径均减小
b.元素金属性逐渐减弱,非金属性逐渐增强
c.氧化物的水化物的碱性逐渐减弱,酸性逐渐增强
d.单质的熔点逐渐降低
(2)原子最外层电子数与次外层电子数相同的元素名称为_______ ,氧化性最弱的简单阳离子是________ 。
(3)已知:
①工业制镁时,电解熔融MgCl2而不电解熔融MgO的原因是__________________ 。
②工业制铝时,电解熔融Al2O3而不电解熔融AlCl3的原因是__________ 。
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是__________ (填标号)。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时KClO3分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴、阳离子个数比为1:1,写出该反应的化学方程式:__________ 。
(1)按原子序数递增的顺序(稀有气体元素除外),下列说法正确的是
a.原子半径和离子半径均减小
b.元素金属性逐渐减弱,非金属性逐渐增强
c.氧化物的水化物的碱性逐渐减弱,酸性逐渐增强
d.单质的熔点逐渐降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2852 | 2050 | 714 |
|
①工业制镁时,电解熔融MgCl2而不电解熔融MgO的原因是
②工业制铝时,电解熔融Al2O3而不电解熔融AlCl3的原因是
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时KClO3分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴、阳离子个数比为1:1,写出该反应的化学方程式:
您最近半年使用:0次




