1 . 下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是
| X | ||
| Y | Z | W |
| T |
| A.X、W、Z元素的气态氢化物的热稳定性依次增强 |
| B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次增强 |
| C.液态WX3汽化需克服的作用力与NaCl熔化需克服的作用力相同 |
| D.根据元素周期律,可以推测T元素的单质具有半导体性能,T2X3具有氧化性和还原性 |
您最近半年使用:0次
2 . 已知氟、氯、溴、碘在元素周期表中位于同一纵行,都是典型的非金属元素,都能与大多数金属化合生成盐,故统称为卤素。卤素单质都具有氧化性,其氧化性强弱顺序是F2>Cl2>Br2>I2,它们都能与H2、H2O等反应。
(1)若用X2表示卤素单质,则X2与H2化合的化学方程式是_______ ,其反应条件难易规律是_______ 。
(2)氧化性强的卤素单质(如Cl2)能把氧化性弱的卤素从其卤化物(如NaBr或KI)中置换出来。请写出将氯气通入碘化钾溶液中的化学方程式________ 。
(3)已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
①氯化铝是_______ 。(填“离子化合物”或“共价化合物”)
②在500 K和1.01×105 Pa时,它的蒸气密度(换算为标准状况时)为11.92 g·L-1,试确定氯化铝在蒸气状态时的化学式为_______ 。
③设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是_______ 。
(1)若用X2表示卤素单质,则X2与H2化合的化学方程式是
(2)氧化性强的卤素单质(如Cl2)能把氧化性弱的卤素从其卤化物(如NaBr或KI)中置换出来。请写出将氯气通入碘化钾溶液中的化学方程式
(3)已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
①氯化铝是
②在500 K和1.01×105 Pa时,它的蒸气密度(换算为标准状况时)为11.92 g·L-1,试确定氯化铝在蒸气状态时的化学式为
③设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是
您最近半年使用:0次
3 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系
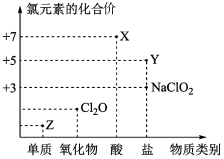
回答下列问题:
(1)X的电离方程式为________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=______ 。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为__ ;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别__ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的__ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为__ 。

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
您最近半年使用:0次
名校
解题方法
4 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
请回答下列问题。
(1)非金属性最强的元素名称为___________ ,它位于元素周期表中的位置___________ 。
(2)硅元素的原子结构示意图是____________ ,其最高价氧化物是____________ (填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________ (填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________ 。
(4)NH3的电子式为________________ ,它属于____________ (填“离子”或“共价”)化合物。NH3的还原性_________ (填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________ 。
| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
(1)非金属性最强的元素名称为
(2)硅元素的原子结构示意图是
(3)硼酸(H3BO3)的酸性
(4)NH3的电子式为
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式
您最近半年使用:0次
2019-06-06更新
|
222次组卷
|
4卷引用:甘肃省武威第五中学2018-2019学年高一下学期5月月考化学试题
2019高二下·全国·专题练习
5 . 甲、乙、丙、丁4种分子中均含有18个电子,分子中都含有2种或3种元素,甲气体溶于水后,长时间放置于空气中有固体析出。下列推断合理的是
| A.将甲气体通入烧碱溶液中,反应后只可能生成一种盐 |
| B.乙和甲中同种元素的质量分数相等,则乙既有氧化性,又有还原性 |
| C.丙与氧气的摩尔质量相同,则丙一定只含有极性键 |
| D.丁中含有第2周期ⅣA族元素,则丁一定是甲烷的同系物 |
您最近半年使用:0次
名校
6 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是5种短周期主族元素的相关信息。
回答下列问题:
(1)X在元素周期表中的位置为___________ 。
(2)由Y与Z形成的一种化合物可作供氧剂,该化合物中所含化学键的类型为___________ ,该化合物的电子式为___________ 。
(3)Y、Z、Q的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(4)向 的碳酸氢盐溶液中滴加
的碳酸氢盐溶液中滴加 溶液,产生白色沉淀和气体,该条件下反应的离子方程式为
溶液,产生白色沉淀和气体,该条件下反应的离子方程式为___________ 。
(5)研究W、Q非金属性强弱的方案中不可行的是___________(填序号)。
| 元素 | 信息 |
| X | 其中一种核素在考古时常用来测定文物的年代 |
| Y | 最外层电子数是次外层电子数的3倍 |
| Z | 短周期主族元素中,其原子半径最大 |
| W | 常温下,其单质是一种黄绿色的气体 |
| Q | 最高化合价与最低化合价的代数和为4 |
(1)X在元素周期表中的位置为
(2)由Y与Z形成的一种化合物可作供氧剂,该化合物中所含化学键的类型为
(3)Y、Z、Q的简单离子半径由大到小的顺序为
(4)向
 的碳酸氢盐溶液中滴加
的碳酸氢盐溶液中滴加 溶液,产生白色沉淀和气体,该条件下反应的离子方程式为
溶液,产生白色沉淀和气体,该条件下反应的离子方程式为(5)研究W、Q非金属性强弱的方案中不可行的是___________(填序号)。
| A.比较其简单氢化物的沸点 | B.比较其单质与氢气反应的难易程度 |
| C.比较其简单阴离子的还原性 | D.比较其氧化物的水化物的酸性 |
您最近半年使用:0次
7 . 一种麻醉剂的分子结构式如图所示。X、Y、Z、W、E是原子序数依次增大的主族元素,且位于三个不同的短周期,其中元素E的原子比W原子多8个电子。下列说法正确的是
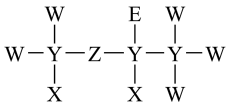
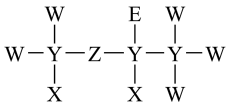
A.原子半径: | B.X与Z形成的化合物中只含有极性键 |
C.最高价氧化物的水化物的酸性: | D.同周期元素形成的单质中W氧化性最强 |
您最近半年使用:0次
解题方法
8 . 探究硫及其化合物的性质,下列方案设计、现象和结论都正确的是
| 选项 | 目的 | 方案设计 | 现象和结论 |
| A | 判断 的化学键类型 的化学键类型 | 将 固体溶于水,进行导电性实验, 固体溶于水,进行导电性实验, 溶液可导电 溶液可导电 |  中含有离子键 中含有离子键 |
| B | 证明 水溶液的酸性与漂白性 水溶液的酸性与漂白性 | 分别在石蕊溶液与品红溶液中通入适量 气体 气体 | 石蕊溶液变红后没有褪色,品红溶液褪色,说明 水溶液呈酸性,有漂白性 水溶液呈酸性,有漂白性 |
| C | 证明浓硫酸具有强氧化性 | 加热浓硫酸、 固体与 固体与 固体的混合物 固体的混合物 | 有黄绿色气体产生,说明浓硫酸具有强氧化性 |
| D | 比较S与 的非金属性强弱 的非金属性强弱 | 用 试纸测定 试纸测定 的 的 和 和 溶液的 溶液的 | 若前者的试纸颜色比后者深,说明非金属性: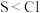 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
9 . W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X、Y三种元素原子的最外层电子数之和为11;W、X同周期且相邻,W的最外层电子数为4,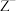 的M层有8个电子。下列结论正确的是
的M层有8个电子。下列结论正确的是
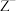 的M层有8个电子。下列结论正确的是
的M层有8个电子。下列结论正确的是| A.X、Y、Z离子半径的大小顺序为Z>Y>X |
| B.Y与Z形成的化合物为共价化合物 |
| C.最高价氧化物对应的水化物的酸性:Z<W |
| D.单质氧化性:Z>X |
您最近半年使用:0次
2023-01-20更新
|
285次组卷
|
5卷引用:河南省叶县高级中学2022-2023学年高一上学期1月期末考试化学试题
9-10高二下·上海松江·阶段练习
10 . 下列叙述中,错误的是
| A.离子键只存在于离子化合物中,不存在于共价化合物中 |
| B.含有共价键的化合物为共价化合物 |
| C.硫单质与金属铁反应生成硫化亚铁(FeS),体现了硫单质的氧化性 |
| D.FeCl2既有氧化性,又有还原性,不能通过铁和氯气反应制得FeCl2 |
您最近半年使用:0次



