名校
解题方法
1 . 元素周期表中铋元素的数据见图,下列说法不正确的是

| A.铋原子s轨道的形状是球形的,p轨道的形状是哑铃形 |
| B.铋元素的相对原子质量是209.0 |
| C.铋原子6p能级中6px、6py、6pz轨道上各有一个电子 |
| D.铋原子最外层有5个能量相同的电子 |
您最近一年使用:0次
2022-10-01更新
|
438次组卷
|
10卷引用:贵州省黄平县且兰高级中学2018-2019学年高二上学期12月份考试化学试题
贵州省黄平县且兰高级中学2018-2019学年高二上学期12月份考试化学试题安徽省郎溪中学2018-2019学年高二下学期第一次月考化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期中考试化学试题山西省怀仁市大地学校2020-2021学年高二下学期第三次月考化学试题山西省朔州市怀仁市大地学校2021-2022学年高二上学期第四次月考化学试题鲁科版2019选择性必修2第1章综合检测卷海南省东方市东方中学2021-2022学年高二下学期期中考试化学试题黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期中考试化学试题(已下线)第1讲 原子结构 核外电子排布山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
名校
解题方法
2 . 最近我国科研人员发现了一种安全、高效的点击化学试剂FSO2N3,下列有关元素F、S、O、N的说法正确的是
| A.电负性:F>O>N>S |
| B.第一电离能:F>S>O>N |
| C.最高正价:F>S=O>N |
| D.S原子的基态原子核外未成对电子数最多 |
您最近一年使用:0次
2020-12-19更新
|
1326次组卷
|
8卷引用:山东省百所名校2021届高三12月联考化学试题
山东省百所名校2021届高三12月联考化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(A卷)山东省部分省重点中学2021届高三第二次质量监测联考化学试题江苏省溧水高级中学2020-2021学年高二下学期4月调研化学试题专题2 原子结构与元素性质 ★第二单元综合拔高练第一章原子结构与性质(提升卷)2.2.2元素第一电离能和电负性的周期性变化 课后
3 . 中科院宁波研究所的“固态锂电池”即将量产,其技术世界领先。请完成下列问题:
(1)基态锂原子的电子排布式:______ ;基态锂原子中有_____ 种运动状态不同的电子。
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。
①上述反应中涉及的元素的原子半径最大的是______ (填元素名称)。
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:_______ 。
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:_______ 。
(3)Mg与 Al的电离能如下(kJ·mol-1):
第一电离能 Mg大于 Al,但第二电离能 Mg小于 Al,解释原因:_________ 。
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为__________ 。
(1)基态锂原子的电子排布式:
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2
 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。①上述反应中涉及的元素的原子半径最大的是
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:
(3)Mg与 Al的电离能如下(kJ·mol-1):
| Mg | 737.7 | 1450.7 | … |
| Al | 577.5 | 1816.7 | … |
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为
您最近一年使用:0次
2020-08-21更新
|
165次组卷
|
3卷引用:山西省运城市2019-2020学年高二下学期期末测试化学试题
山西省运城市2019-2020学年高二下学期期末测试化学试题吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)
4 . 观察1s轨道电子云示意图,判断下列说法正确的是( )


| A.一个小黑点表示1个自由运动的电子,图中有无数个电子 |
| B.1s轨道的电子云形状为圆形的面 |
| C.电子在1s轨道上运动像地球围绕太阳旋转 |
| D.1s轨道电子云的点的疏密表示电子在某一位置出现概率的多少 |
您最近一年使用:0次
名校
5 . 下列表达方式或说法正确的是
A.CO2的分子模型示意图: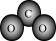 |
B.某元素原子R的轨道表示式: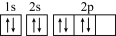 |
C.pp π键电子云模型: |
D.乙烯分子的球棍模型: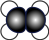 |
您最近一年使用:0次
2019-04-08更新
|
226次组卷
|
4卷引用:山西省沁县中学2018-2019学年高二下学期第一次月考化学试题
名校
6 . 玻尔理论、量子力学理论都是对核外电子运动的描述方法,根据对它们的理解,下列叙述中正确的是
| A.因为轨道的形状是球形的,所以电子做的是圆周运动 |
| B.3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 |
| C.处于同一轨道上的电子可以有多个,它的运动状态完全相同 |
| D.原子轨道和电子云都是用来形象地描述电子运动状态的 |
您最近一年使用:0次
2019-04-08更新
|
142次组卷
|
3卷引用:山西省沁县中学2018-2019学年高二下学期第一次月考化学试题
山西省沁县中学2018-2019学年高二下学期第一次月考化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题(已下线)【2023】【高二下】【期中考】【浙附丁兰】【高中化学】【霍钰涵收集】
名校
7 . 若某原子在处于能量最低状态时,外围电子排布为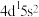 ,则下列说法错误的是
,则下列说法错误的是
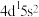 ,则下列说法错误的是
,则下列说法错误的是| A.该元素可能有+3价 |
| B.该元素位于第5周期副族 |
| C.该元素原子核外共有39个不同运动状态的电子 |
| D.该元素基态原子第N能层上还有5个空轨道 |
您最近一年使用:0次
2019-03-16更新
|
428次组卷
|
6卷引用:【全国百强校】山西省山西大学附属中学2018-2019学年高二下学期2月模块诊断化学试题
名校
8 . FeSe、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________ ,基态Se原子的电子占据最高能级的电子云轮廓图为________ 形。
(2)向FeSe中嵌入吡啶(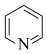 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________ ;该分子内存在________ (填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________ 。
②液氨是氨气液化的产物,氨气易液化的原因是________ 。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________ 。
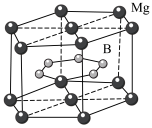
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________ 个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏伽德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)向FeSe中嵌入吡啶(
 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为
②液氨是氨气液化的产物,氨气易液化的原因是
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有
您最近一年使用:0次
2019-03-02更新
|
407次组卷
|
4卷引用:山西运城市运康中学校2019-2020学年高三12月月考化学试题
9 . (1)某元素原子的价电子构型为4s24p1,该元素的符号为________ 。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为________ 。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为________ ,B的元素名称为________ 。
(4)如图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
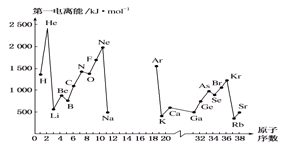
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________ <Al<________ ;(填元素符号)。
②图中第一电离能最小的元素在周期表中的位置是第________ 周期________ 族。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为
(4)如图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。

①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为
②图中第一电离能最小的元素在周期表中的位置是第
您最近一年使用:0次
10 . 下列各项叙述中,正确的是
| A.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| B.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| C.24Cr原子的电子排布式是1s22s22p63s23p63d44s2 |
| D.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
您最近一年使用:0次
2018-07-25更新
|
330次组卷
|
2卷引用:【全国校级联考】辽宁省抚顺市六校2017-2018学年高二下学期期末考试化学试题



