1 . 确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______ ; B.______ ; C._____ ; D._____ 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:

则该4种离子晶体的熔点从高到低的顺序是______ 。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____ ,X+的价电子排布式为_____ ,与同一个N3-相连的X+有_____ 个,这几个X+所形成的空间构型为_____ 。

(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | KCl | MgO | CaO |
| 晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是

您最近一年使用:0次
解题方法
2 . 硫及其化合物有许多用途。相关物质的物理常数如表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____ 。
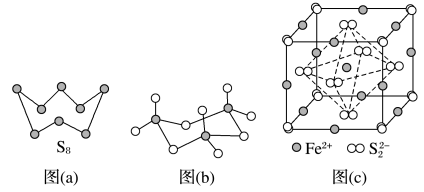
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______ 。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________ ,晶胞边长为anm,FeS2相对式量为M、阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为_____ g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______ nm。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数
您最近一年使用:0次
名校
3 . 下列表达方式或说法正确的是
A.CO2的分子模型示意图: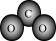 |
B.某元素原子R的轨道表示式: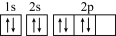 |
C.pp π键电子云模型: |
D.乙烯分子的球棍模型: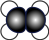 |
您最近一年使用:0次
2019-04-08更新
|
226次组卷
|
4卷引用:内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题
4 . 下列说法正确的是
①电子云中的一个小黑点代表一个电子
②电子云密度大的地方,说明电子在核外空间单位时间内出现的机会多
③原子轨道是指原子运行的轨道
④s电子的电子云呈球形,p电子的电子云呈哑铃形
①电子云中的一个小黑点代表一个电子
②电子云密度大的地方,说明电子在核外空间单位时间内出现的机会多
③原子轨道是指原子运行的轨道
④s电子的电子云呈球形,p电子的电子云呈哑铃形
| A.①② | B.②③ |
| C.③④ | D.②④ |
您最近一年使用:0次
2018-04-20更新
|
356次组卷
|
6卷引用:山西省实验中学2017-2018学年高二下学期第一次月考化学试题
名校
解题方法
5 . 下列描述中正确的是
| A.CS2 为空间构型为 V 形的极性分子 |
| B.双原子或多原子形成的气体单质中,一定有σ键,可能有π键 |
| C.氢原子电子云的一个小黑点表示一个电子 |
| D.HCN、SiF4 和 SO32- 的中心原子均为 sp3 杂化 |
您最近一年使用:0次
2018-01-18更新
|
407次组卷
|
8卷引用:【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校2017-2018学年高二上学期期末考试化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期开学考试化学试题【全国百强校】福建省厦门第一中学2018-2019学年高二上学期期中考试化学试题安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题辽宁省六校协作体2019-2020高二下学期期初考试化学试卷辽宁省大连市普兰店市第三十八中学2021届高三第一学期开学考试化学试题(已下线)第二单元 化学键与分子间作用力(能力提升卷)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
名校
6 . 下列有关电子云的叙述中,正确的是( )
| A.电子云形象地表示了电子在核外某处单位体积内出现的概率 |
| B.电子云直观地表示了核外电子的数目 |
| C.1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零 |
| D.电子云是电子绕核运动形成了一团带负电荷的云雾 |
您最近一年使用:0次
2016-12-09更新
|
221次组卷
|
8卷引用:内蒙古包头市第四中学2017-2018学年高二上学期期末考试化学试题



