确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______ ; B.______ ; C._____ ; D._____ 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:

则该4种离子晶体的熔点从高到低的顺序是______ 。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____ ,X+的价电子排布式为_____ ,与同一个N3-相连的X+有_____ 个,这几个X+所形成的空间构型为_____ 。

(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | KCl | MgO | CaO |
| 晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是

更新时间:2020-07-10 22:18:39
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】我国科学家研发的新型光学材料(Sn7Br10S2)可替代传统光学材料硫镓银(AgGaS2)和磷锗锌(ZnGeP2)。请回答下列问题:
(1)基态硫原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为___________ 。
(2)SF6可用作高压发电系统的绝缘气体,其分子呈正八面体结构,如图所示。
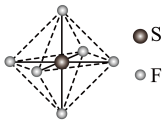
①SF6是___________ (填“极性”或“非极性”)分子。
②1molSF6分子中含___________ molσ键。
(3)HF、HCl、HBr的酸性由强到弱的顺序为___________ (填化学式,下同);沸点由高到低的顺序为___________ ;还原性由强到弱的顺序为___________ 。
(4)Ga(CH3)3和NH3在一定条件下可合成半导体材料GaN和CH4。Ga(CH3)3分子中Ga原子和C原子构成的空间构型是___________ ,碳原子的杂化类型是___________ 。
(5)四卤化锡的熔点如下表所示:
它们熔点递变的主要原因是___________ 。
(1)基态硫原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为
(2)SF6可用作高压发电系统的绝缘气体,其分子呈正八面体结构,如图所示。

①SF6是
②1molSF6分子中含
(3)HF、HCl、HBr的酸性由强到弱的顺序为
(4)Ga(CH3)3和NH3在一定条件下可合成半导体材料GaN和CH4。Ga(CH3)3分子中Ga原子和C原子构成的空间构型是
(5)四卤化锡的熔点如下表所示:
| 物质 | SnCl4 | SnBr4 | SnI4 |
| 熔点/℃ | ﹣33 | 31 | 144.5 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)请写出Q元素基态原子的外围电子排布图:_______ 。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是__________ (用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是__________ 。
(4)写出Z元素的原子核外电子排布式_________ 。
(5)Q元素原子的未成对电子个数是________ 个。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ/mol)依次为 578、1 817、2 745、11 575、14 830、18 376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
(1)请写出Q元素基态原子的外围电子排布图:
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(4)写出Z元素的原子核外电子排布式
(5)Q元素原子的未成对电子个数是
您最近一年使用:0次
【推荐3】近年来,我国航空航天事业成果显著,航空航天材料技术快速发展。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。钛在周期表中的位置为___ ,基态钛原子的价层电子排布式为___ 。
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,砷的电负性略___ 镓(填“>”“<”),基态镓原子电子占据最高能级的电子云轮廓图为___ 形。
(3)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的最低能量状态的是___ 。碳在成键时,能将一个2s电子激发进入2p能级而参与成键,写出该激发态原子的核外电子排布式___ 。
A.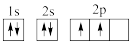 B.
B.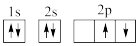
C.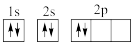 D.
D.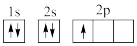
②氧原子的基态原子核外有___ 个未成对电子,有___ 种不同形状的电子云。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。钛在周期表中的位置为
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,砷的电负性略
(3)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的最低能量状态的是
A.
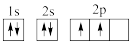 B.
B.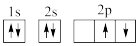
C.
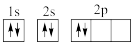 D.
D.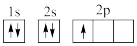
②氧原子的基态原子核外有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮元素有着多变价态和种类繁多的化合物,在工农业生产中有重要的应用。
(1)同周期元素中,比氮元素的第一电离能大的元素共有______________ 种。
(2)NF3与汞共热可制得N2F2。
①NF3的几何构型为______________ ,N2F2 中σ键和π键的个数比为_____________ 。
②已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为_____________ 。
(3)H3N-BH3分子中B原子的杂化轨道类型为_________ ,该分子的熔沸点比乙烷高,原因是________________________ 。
(4)由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为1:1: 8,其阴阳离子是等电子体,该化合物中的阴离子是__________ (填离子符号)。
(5)氮化硼晶体结构如图所示。
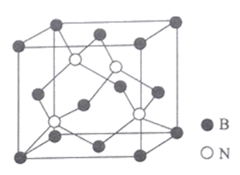
①该晶体中含有的微粒间作用力为______________________ 。
②图中N原子的坐标参数为 ( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );
);________ 。
③已知BN晶胞中相邻且最近的硼、氢原子的核间距为acm,NA为阿伏加 德罗常数的值.其密度为_____________ g•cm-3 (列出计算式即可)。
(1)同周期元素中,比氮元素的第一电离能大的元素共有
(2)NF3与汞共热可制得N2F2。
①NF3的几何构型为
②已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为
(3)H3N-BH3分子中B原子的杂化轨道类型为
(4)由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为1:1: 8,其阴阳离子是等电子体,该化合物中的阴离子是
(5)氮化硼晶体结构如图所示。

①该晶体中含有的微粒间作用力为
②图中N原子的坐标参数为 (
 ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );
);③已知BN晶胞中相邻且最近的硼、氢原子的核间距为acm,NA为阿伏加 德罗常数的值.其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)某同学画出基态碳原子的轨道表示式: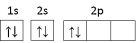 ,该表示式违背了
,该表示式违背了___ ;CH 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 的空间构型为
的空间构型为____ ;CH 中C原子成键的杂化方式为
中C原子成键的杂化方式为_____ 。
(2)34号元素硒的基态原子的价层电子排布式为_______ 。
(3)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为_____ ,有_____ %的正八面体空隙没有填充阳离子。
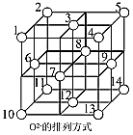
(4)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。
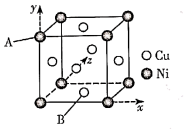
①原子B的坐标参数为____ ;
②若该晶体密度为dg·cm-3,则铜镍原子间最短距离为____ 。
(1)某同学画出基态碳原子的轨道表示式:
 ,该表示式违背了
,该表示式违背了 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 的空间构型为
的空间构型为 中C原子成键的杂化方式为
中C原子成键的杂化方式为(2)34号元素硒的基态原子的价层电子排布式为
(3)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为

(4)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。

①原子B的坐标参数为
②若该晶体密度为dg·cm-3,则铜镍原子间最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜纳米催化剂室温催化氨硼烷产氢串联选择性还原催化3-硝基苯乙烯到3-氨基苯乙烯”在有机化学选择性加氢反应研究领域取得重要进展。
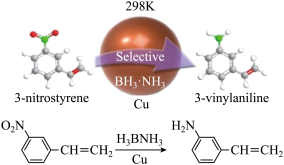
请回答下列问题:
(1)下列分别为B、C、N、Cu基态原子价电子排布图,其中正确的是___________(填标号)
(2)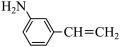 物质的沸点高于
物质的沸点高于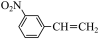 ,原因是
,原因是___________ ,硝基(-NO2)和氨基(-NH2)中N的杂化方式分别为___________ 。
(3)SiC结构类似金刚石,则SiC为_____ 晶体。图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),其余Si原子位于大正方体的_______ 位置。
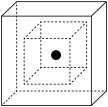
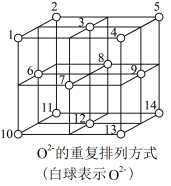
(4)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。Fe3+比Fe2+稳定性更好,原因是_________ 。O2-的重复排列方式如图所示,晶胞中O2-个数为_________ ,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,有______ %正四面体空隙填有Fe3+。

请回答下列问题:
(1)下列分别为B、C、N、Cu基态原子价电子排布图,其中正确的是___________(填标号)
A.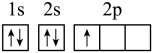 | B.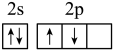 |
C.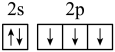 | D.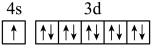 |
(2)
 物质的沸点高于
物质的沸点高于 ,原因是
,原因是(3)SiC结构类似金刚石,则SiC为

(4)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。Fe3+比Fe2+稳定性更好,原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】硼及其化合物在工业上有重要的用途,回答下列问题:
(1)基态硼原子有_______ 个不同运动状态的电子,基态硼原子最高能级的电子排布式为_______ 。
(2)BF3能与多种物质化合。
①气态BF3与无水乙醚可化合生成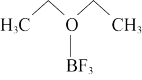 ,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为
,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为_______ 。
②BF3与NH3可形成“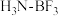 ”分子,其原因是
”分子,其原因是_______ 。
(3)硼原子和磷原子能形成共价晶体磷化硼,其密度为 ,晶胞如图所示:
,晶胞如图所示:
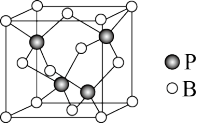
①磷化硼的化学式为_______ 。
②硼原子的配位数为_______ 。
③其晶胞参数a=_______ pm(B的相对原子质量为10.8,P的相对原子质量为31,阿伏加德罗常数的值用 表示)。
表示)。
(1)基态硼原子有
(2)BF3能与多种物质化合。
①气态BF3与无水乙醚可化合生成
 ,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为
,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为②BF3与NH3可形成“
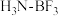 ”分子,其原因是
”分子,其原因是(3)硼原子和磷原子能形成共价晶体磷化硼,其密度为
 ,晶胞如图所示:
,晶胞如图所示:
①磷化硼的化学式为
②硼原子的配位数为
③其晶胞参数a=
 表示)。
表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】研究表明,低硒或缺硒人群适量补硒不但能够预防肿瘤、肝病等的发生,而且可以提高机体免疫力,维护心、肝、肺、胃等重要器官的正常功能,预防老年性心脑血管疾病的发生。请回答下列问题:
(1) 的晶体类型为
的晶体类型为_______ 。
(2) 分子中含有
分子中含有_______ (填“极性”或“非极性”)共价键; 水溶液的酸性比
水溶液的酸性比 水溶液的酸性更强,原因是
水溶液的酸性更强,原因是_______ 。
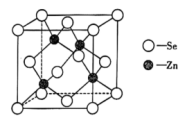
(3)硒化锌是一种重要的半导体材料,其晶胞结构如图所示。若该晶胞的密度为 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为 ,用
,用 表示阿伏加德罗常数的值,则晶胞参数a为
表示阿伏加德罗常数的值,则晶胞参数a为_______ pm。
(1)
 的晶体类型为
的晶体类型为(2)
 分子中含有
分子中含有 水溶液的酸性比
水溶液的酸性比 水溶液的酸性更强,原因是
水溶液的酸性更强,原因是(3)硒化锌是一种重要的半导体材料,其晶胞结构如图所示。若该晶胞的密度为
 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为 ,用
,用 表示阿伏加德罗常数的值,则晶胞参数a为
表示阿伏加德罗常数的值,则晶胞参数a为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S A+N2↑+3CO2↑(已配平)。
A+N2↑+3CO2↑(已配平)。
①除S外,上列元素的电负性从大到小依次为________ 。
②在生成物中,A的晶体类型为____________ A的电子式为__________ 。
③原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子外围电子(价电子)排布为____________ ,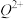 的未成对电子数是
的未成对电子数是_________ 。
 A+N2↑+3CO2↑(已配平)。
A+N2↑+3CO2↑(已配平)。①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的晶体类型为
③原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子外围电子(价电子)排布为
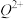 的未成对电子数是
的未成对电子数是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】(1)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论。
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱。试写出液氨自身电离的方程式:___________________________ 。
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论。凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是_______________ 。
A、H2O B、NH4+ C、OH- D、HCO3 E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念。凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸。
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O。
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3+H2O H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是______ (填H3BO3或H2O);
(Ⅱ)NaH+H2O ==NaOH+H2↑,该反应中的酸是_____________ (填NaH 或H2O)。
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满。D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1。按要求填写
① B的电子排布式是:________________ ,A、B两元素形成的化合物的晶体类型是_______ 。
②D元素单质的晶体类型是___________ ,C单质的制备方法是:___________ 。
③E和F形成的化合物空间构型为_____________ ,该物质比D与E形成的化合物更容易液化的原因是______________________ 。
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱。试写出液氨自身电离的方程式:
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论。凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是
A、H2O B、NH4+ C、OH- D、HCO3 E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念。凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸。
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O。
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3+H2O
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是(Ⅱ)NaH+H2O ==NaOH+H2↑,该反应中的酸是
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满。D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1。按要求填写
① B的电子排布式是:
②D元素单质的晶体类型是
③E和F形成的化合物空间构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料。回答下列问题:
(1)基态硒原子的核外电子排布式为[Ar]__________ ,核外电子占据的最高能层的符号是________________ 。
(2)砷与锗、硒是同周期主族元素,该三种元素的第一电离能由大到小的顺序为_______________________ 。
(3)单晶锗具有金刚石结构,其原子之间存在的作用力为__________________ 。
(4)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是____________ 。硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______________ ,丁硅烯(Si4H8)中 键与
键与 键个数之比为
键个数之比为______________ 。
(5)已知GaCl3的熔点77. 9 °C ,沸点201°C ; GeCl4的熔点 -49. 5 °C ,沸点84 °C,则GaCl3的晶体类型为______________ ,GaCl3的杂化轨道类型为_____________ ,GeCl4的空间构型为_________________ 。
(6)砷化稼的晶胞结构如图所示,若该晶体密度为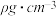 ]则晶胞参数a =
]则晶胞参数a =_____________ cm (用NA表示阿伏加 德罗常数)。
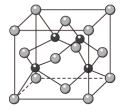
(1)基态硒原子的核外电子排布式为[Ar]
(2)砷与锗、硒是同周期主族元素,该三种元素的第一电离能由大到小的顺序为
(3)单晶锗具有金刚石结构,其原子之间存在的作用力为
(4)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是
 键与
键与 键个数之比为
键个数之比为(5)已知GaCl3的熔点77. 9 °C ,沸点201°C ; GeCl4的熔点 -49. 5 °C ,沸点84 °C,则GaCl3的晶体类型为
(6)砷化稼的晶胞结构如图所示,若该晶体密度为
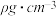 ]则晶胞参数a =
]则晶胞参数a =
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】(现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)由表格可知,A组熔点普遍偏高,据此回答:
①A组属于__________ 晶体,其熔化时克服的粒子间的作用力是__________ ;
②硼晶体的硬度________ 硅晶体的硬度(填“大于”“小于”)。
(2)B组中 熔点反常是由于
熔点反常是由于__________ 。
(3)C组晶体中 、
、 、
、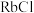 的熔点由高到低的顺序为
的熔点由高到低的顺序为_________ , 晶体的熔点高于三者,其原因是
晶体的熔点高于三者,其原因是________________ 。
(4)氢化铝钠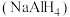 是一种新型轻质储氢材料,掺入少量
是一种新型轻质储氢材料,掺入少量 的
的 在150℃时释氢,在170℃、
在150℃时释氢,在170℃、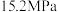 条件下又重复吸氢。
条件下又重复吸氢。 的晶胞结构如图所示:
的晶胞结构如图所示:
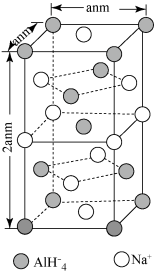
 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有___________ 个; 晶体的密度为
晶体的密度为________  (用含a的代数式表示)。若
(用含a的代数式表示)。若 晶胞底心处的
晶胞底心处的 被
被 取代,得到的晶体为
取代,得到的晶体为_________ (填化学式)。
| A组 | B组 | C组 |
| 金刚石:3550 |  : :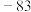 |  |
| 硅晶体:1410 |  : :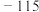 |  |
| 硼晶体:2300 |  : :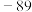 | 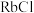 |
| 二氧化硅:1732 |  : :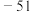 |  :2800℃ :2800℃ |
(1)由表格可知,A组熔点普遍偏高,据此回答:
①A组属于
②硼晶体的硬度
(2)B组中
 熔点反常是由于
熔点反常是由于(3)C组晶体中
 、
、 、
、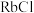 的熔点由高到低的顺序为
的熔点由高到低的顺序为 晶体的熔点高于三者,其原因是
晶体的熔点高于三者,其原因是(4)氢化铝钠
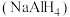 是一种新型轻质储氢材料,掺入少量
是一种新型轻质储氢材料,掺入少量 的
的 在150℃时释氢,在170℃、
在150℃时释氢,在170℃、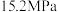 条件下又重复吸氢。
条件下又重复吸氢。 的晶胞结构如图所示:
的晶胞结构如图所示:
 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有 晶体的密度为
晶体的密度为 (用含a的代数式表示)。若
(用含a的代数式表示)。若 晶胞底心处的
晶胞底心处的 被
被 取代,得到的晶体为
取代,得到的晶体为
您最近一年使用:0次



