镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料。回答下列问题:
(1)基态硒原子的核外电子排布式为[Ar]__________ ,核外电子占据的最高能层的符号是________________ 。
(2)砷与锗、硒是同周期主族元素,该三种元素的第一电离能由大到小的顺序为_______________________ 。
(3)单晶锗具有金刚石结构,其原子之间存在的作用力为__________________ 。
(4)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是____________ 。硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______________ ,丁硅烯(Si4H8)中 键与
键与 键个数之比为
键个数之比为______________ 。
(5)已知GaCl3的熔点77. 9 °C ,沸点201°C ; GeCl4的熔点 -49. 5 °C ,沸点84 °C,则GaCl3的晶体类型为______________ ,GaCl3的杂化轨道类型为_____________ ,GeCl4的空间构型为_________________ 。
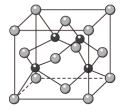
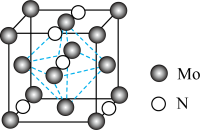
(6)砷化稼的晶胞结构如图所示,若该晶体密度为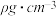 ]则晶胞参数a =
]则晶胞参数a =_____________ cm (用NA表示阿伏加 德罗常数)。
(1)基态硒原子的核外电子排布式为[Ar]
(2)砷与锗、硒是同周期主族元素,该三种元素的第一电离能由大到小的顺序为
(3)单晶锗具有金刚石结构,其原子之间存在的作用力为
(4)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是
 键与
键与 键个数之比为
键个数之比为(5)已知GaCl3的熔点77. 9 °C ,沸点201°C ; GeCl4的熔点 -49. 5 °C ,沸点84 °C,则GaCl3的晶体类型为
(6)砷化稼的晶胞结构如图所示,若该晶体密度为
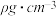 ]则晶胞参数a =
]则晶胞参数a =
更新时间:2019-06-26 18:02:52
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铜是人类最早发现并广泛使用的一种金属.黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式.回答下列问题:
(1)Cu的价电子排布式为_________ ,CuFeS2中三种元素的电负性从大到小的顺序为________________ (用元素符号表示)。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是___________ ,中心原子杂化类型为_____________ 。
②X的沸点比水的沸点低,主要原因是_____________ 。
(3)血红素是铁卟啉化合物,是血红蛋白的组成部分,其结构如图1所示,该化合物中的化学键有_____________ (填标号)
A.金属键 B. 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键
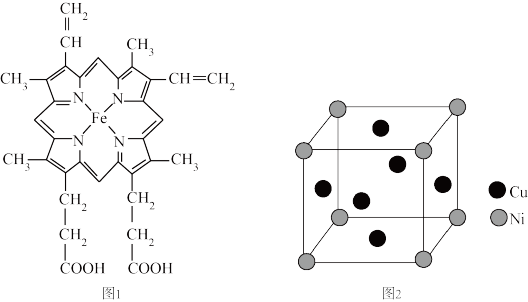
(4)某镍白铜合金的立方晶胞结构如图2所示:
①晶胞中铜原子与镍原子的数目之比为________ 。
②若该合金的晶胞边长为 ,则该合金的密度为
,则该合金的密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)
(1)Cu的价电子排布式为
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是
②X的沸点比水的沸点低,主要原因是
(3)血红素是铁卟啉化合物,是血红蛋白的组成部分,其结构如图1所示,该化合物中的化学键有
A.金属键 B.
 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键
(4)某镍白铜合金的立方晶胞结构如图2所示:
①晶胞中铜原子与镍原子的数目之比为
②若该合金的晶胞边长为
 ,则该合金的密度为
,则该合金的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为______________ ,溴的基态原子价电子排布式为_____________ 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____________ (填字母)式发生。
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____ 。
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是__________ (填字母)。
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为______________ ,写出一个与CN—互为等电子体的物质的分子式:______________ 。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为__________ 。已知该氧化物的密度是ρg·cm-3,则晶胞内离得最近的两个钙离子的间距为_________ cm(只要求列算式,不必计算出数值,阿伏加 德罗常数的值为NA)。

(1)COCl2的空间构型为
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氢、氮、氧是重要的非金属元素,在新材料和新能源开发中有重要的作用。
(1)下列状态的O中,最容易失去最外层电子的是_______(填序号)。
(2)MH中基态H-的核外电子的电子云轮廓图呈_______ 。已知H-(g)=H(g)+e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则H-的第二电离能为_______ 。
(3)作为新型高能含能材料AgN5在炸药、推进剂和发射药等领域具有较高的应用价值。
①N 为平面结构,结构为[
为平面结构,结构为[ ],其中N原子的杂化方式是
],其中N原子的杂化方式是_______ ,1mol N 中σ键总数为
中σ键总数为_______ ;
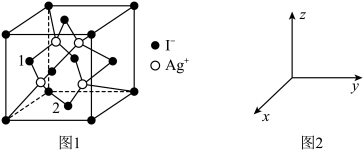
②AgN5的晶体结构与AgI相似。AgI 的一种结构分为γ- AgI立方晶胞的示意图见图1。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2中,原子1的坐标是( ,0,
,0, ),则原子2的坐标为
),则原子2的坐标为_______ 。
(4)氮化硼(BN)是一种性能优异 、潜力巨大的新型材料,主要结构有立方氮化硼(图3)和六方氮化硼(图4),前者类似于金刚石,后者与石墨相似,六方晶胞结构如图5。
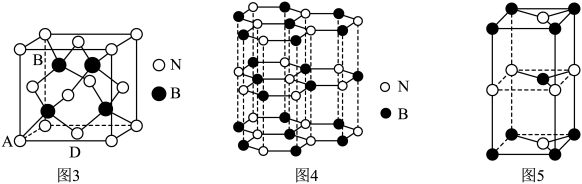
①X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为_______ pm。( = 1.732)
= 1.732)
②已知六方氮化硼同层中B、N原子之间的距离是a cm,层与层之间的距离是b cm,晶体的密度是_______ g/cm3 (不用化简)。
(1)下列状态的O中,最容易失去最外层电子的是_______(填序号)。
| A.1s22s22p3 | B.1s22s22p4 | C.1s22s22p33s1 | D.1s22s22p23s1 |
(3)作为新型高能含能材料AgN5在炸药、推进剂和发射药等领域具有较高的应用价值。
①N
 为平面结构,结构为[
为平面结构,结构为[ ],其中N原子的杂化方式是
],其中N原子的杂化方式是 中σ键总数为
中σ键总数为②AgN5的晶体结构与AgI相似。AgI 的一种结构分为γ- AgI立方晶胞的示意图见图1。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2中,原子1的坐标是(
 ,0,
,0, ),则原子2的坐标为
),则原子2的坐标为
(4)氮化硼(BN)是一种性能优异 、潜力巨大的新型材料,主要结构有立方氮化硼(图3)和六方氮化硼(图4),前者类似于金刚石,后者与石墨相似,六方晶胞结构如图5。

①X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为
 = 1.732)
= 1.732)②已知六方氮化硼同层中B、N原子之间的距离是a cm,层与层之间的距离是b cm,晶体的密度是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮、磷、砷是同族元素,请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为:_____________ (用元素符号表示)。
(2)氨水溶液中存在多种氢键,任意表示出其中一种:____________________ 。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是___________ (填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4)氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因:_____________________ 。
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。
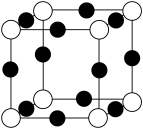
①X的核外电子排布式为________________________ 。与同一个N3-相连的X+有______ 个。
②X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为_____ 。
③请画出[X(H2O)4]2+离子的结构式_________________ (用元素符号写结构式)。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为:
(2)氨水溶液中存在多种氢键,任意表示出其中一种:
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4)氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因:
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。

①X的核外电子排布式为
②X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为
③请画出[X(H2O)4]2+离子的结构式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氧族元素包括氧、硫、硒、碲、钋。
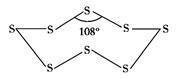
(1)单质硫的同素异形体很多,最常见的是斜方晶硫和单斜晶硫,经过测定,这两种硫的单质都是由S8构成的。S8分子的构型如图所示。S—S键的键角为108°,8个S原子形成两层,每层4个S原子。S8分子中S原子通过_______ 杂化与其他原子成键,斜方晶硫和单斜晶硫中S8分子之间靠_______ 结合在一起。
(2)氧及与其同周期的碳、氮、氟四种原子的第一电离能由大到小的顺序是_____ 。
(3)用元素原子电负性的理论判断,H2O中的O—H键的键角_______ (填“>”、“=”或“<”)H2S中的S—H键的键角。
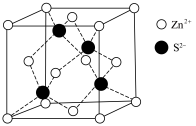
(4)硒是人体生命活动不可缺少的微量元素,适量的硒能够增强人体免疫力,延缓衰老,清除人体内的有害物质。如图是硒(Se)化锶(Sr)的晶胞模型,据此可知,每个硒化锶晶胞中含有的硒离子为_______ 个,其化学式为_______ 。

(1)单质硫的同素异形体很多,最常见的是斜方晶硫和单斜晶硫,经过测定,这两种硫的单质都是由S8构成的。S8分子的构型如图所示。S—S键的键角为108°,8个S原子形成两层,每层4个S原子。S8分子中S原子通过

(2)氧及与其同周期的碳、氮、氟四种原子的第一电离能由大到小的顺序是
(3)用元素原子电负性的理论判断,H2O中的O—H键的键角
(4)硒是人体生命活动不可缺少的微量元素,适量的硒能够增强人体免疫力,延缓衰老,清除人体内的有害物质。如图是硒(Se)化锶(Sr)的晶胞模型,据此可知,每个硒化锶晶胞中含有的硒离子为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氮及其化合物在生产生活中有广泛的应用。回答下列问题:
(1)基态N原子的核外电子共有_______ 种空间运动状态; 第一电离能从大到小的顺序为
第一电离能从大到小的顺序为_______ 。
(2)标准状况下,1体积水最多能溶解0.024体积 ,1体积水最多能溶解0.485体积
,1体积水最多能溶解0.485体积 ,
, 在水中溶解度大于
在水中溶解度大于 的原因是
的原因是_______ 。
(3) 的VSEPR模型为
的VSEPR模型为_______ ,与 互为等电子体的粒子有
互为等电子体的粒子有_______ (任意写出两种)。
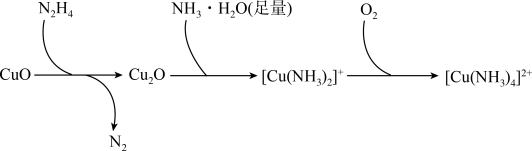
(4)联氨 可用于处理水中的溶解氧,其反应机理如下图所示:
可用于处理水中的溶解氧,其反应机理如下图所示:
① 的沸点高于
的沸点高于 的原因为
的原因为_______ 。
②等物质的量的 与
与 中所含
中所含 键数目之比为
键数目之比为_______ 。
(5)氮化钼晶胞如图所示,氮化钼的化学式为_______ ;若晶胞边长为 ,则晶体的密度为
,则晶体的密度为_______  为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态N原子的核外电子共有
 第一电离能从大到小的顺序为
第一电离能从大到小的顺序为(2)标准状况下,1体积水最多能溶解0.024体积
 ,1体积水最多能溶解0.485体积
,1体积水最多能溶解0.485体积 ,
, 在水中溶解度大于
在水中溶解度大于 的原因是
的原因是(3)
 的VSEPR模型为
的VSEPR模型为 互为等电子体的粒子有
互为等电子体的粒子有(4)联氨
 可用于处理水中的溶解氧,其反应机理如下图所示:
可用于处理水中的溶解氧,其反应机理如下图所示:
①
 的沸点高于
的沸点高于 的原因为
的原因为②等物质的量的
 与
与 中所含
中所含 键数目之比为
键数目之比为(5)氮化钼晶胞如图所示,氮化钼的化学式为
 ,则晶体的密度为
,则晶体的密度为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】硫在古代被列为重要的药材,目前含硫化合物广泛用于医药、农药等。回答下列问题:
(1)基态硫原子的价电子排布图为_______ 。
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一。一种铁硫原子簇的结构如图所示:
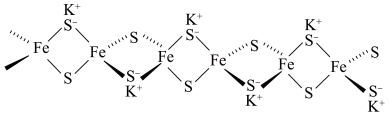
该化合物的化学式为_______ ,中心原子Fe的配位数为_______ 。
(3)解砷灵的结构简式为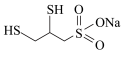 。—SH和—SO3Na中硫原子的杂化轨道类型分别是
。—SH和—SO3Na中硫原子的杂化轨道类型分别是_______ 、_______ ;1 mol 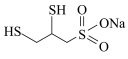 中含
中含_______ mol  键。
键。
(4)H2S及PH3的分子结构及相应的键角如图所示。
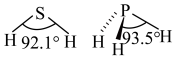
H2S的键角小于PH3的原因是_______ 。
(5)研究表明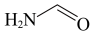 (甲酰胺)可以二聚体形式存在(含八元环结构),分子中存在氢键,氢键的表示形式是
(甲酰胺)可以二聚体形式存在(含八元环结构),分子中存在氢键,氢键的表示形式是_______ 。
(6)立方硫化锌的晶胞结构如图所示,已知晶胞参数为a pm。 的配位数为
的配位数为_______ ; 与
与 间最短距离为
间最短距离为_______ pm。
(1)基态硫原子的价电子排布图为
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一。一种铁硫原子簇的结构如图所示:

该化合物的化学式为
(3)解砷灵的结构简式为
 。—SH和—SO3Na中硫原子的杂化轨道类型分别是
。—SH和—SO3Na中硫原子的杂化轨道类型分别是 中含
中含 键。
键。(4)H2S及PH3的分子结构及相应的键角如图所示。
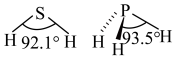
H2S的键角小于PH3的原因是
(5)研究表明
 (甲酰胺)可以二聚体形式存在(含八元环结构),分子中存在氢键,氢键的表示形式是
(甲酰胺)可以二聚体形式存在(含八元环结构),分子中存在氢键,氢键的表示形式是(6)立方硫化锌的晶胞结构如图所示,已知晶胞参数为a pm。
 的配位数为
的配位数为 与
与 间最短距离为
间最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】第Ⅷ族元素铁、钴、镍的单质及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为____ 。
(2)Fe、Co的第四电离能分别为5290kJ·mol-1、4950kJ·mol-1,铁的第四电离能大于钴的第四电离能的主要原因是___ 。
(3)维生素B12的结构如图所示。
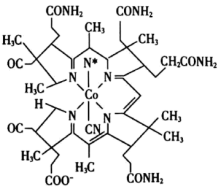
①钴的配位数为___ 。
②CN-与Co3+形成配位键时CN-中C提供孤电子对,而不是N提供孤电子对,其主要原因可能是___ 。
(4)Ni(NH3)2Cl2有两种空间结构,中心离子为___ (填离子符号),则[Ni(CN)4]2-立体结构为___ (填“正四面体”或“平面正方形)。
(5)Fe2+与环戊二烯基形成化合物Fe(C5H5)2,称为二茂铁,二茂铁为橙黄色固体,易溶于乙醚、苯、乙醇等有机溶剂,其熔点为446K。由此推知,二茂铁晶体类型是___ (填“离子晶体”或“分子晶体”)。
(6)由K+、Fe2+、Fe3+、CN-组成的一种立方晶胞如图所示(K+未画出)。
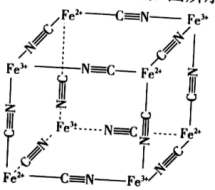
①在该晶胞中碳原子杂化类型为___ 。
②该晶胞内含有的K+数目为___ 。
③已知NA代表阿伏加德罗常数的值,晶胞边长为anm,则该晶体密度为__ g·cm-3。(只列计算式)
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为(2)Fe、Co的第四电离能分别为5290kJ·mol-1、4950kJ·mol-1,铁的第四电离能大于钴的第四电离能的主要原因是
(3)维生素B12的结构如图所示。

①钴的配位数为
②CN-与Co3+形成配位键时CN-中C提供孤电子对,而不是N提供孤电子对,其主要原因可能是
(4)Ni(NH3)2Cl2有两种空间结构,中心离子为
(5)Fe2+与环戊二烯基形成化合物Fe(C5H5)2,称为二茂铁,二茂铁为橙黄色固体,易溶于乙醚、苯、乙醇等有机溶剂,其熔点为446K。由此推知,二茂铁晶体类型是
(6)由K+、Fe2+、Fe3+、CN-组成的一种立方晶胞如图所示(K+未画出)。

①在该晶胞中碳原子杂化类型为
②该晶胞内含有的K+数目为
③已知NA代表阿伏加德罗常数的值,晶胞边长为anm,则该晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;C原子基态成对电子数是未成对电子数的3倍;原子D的简单离子半径在第三周期元素形成的简单离子中最小;E是前四周期中未成对电子数最多的元素。回答下列问题:
(1)元素B、C、D第一电离能由小到大的顺序为_______ 。
(2)BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为_______ 。
(3)下列含B元素的微粒与CO2分子不是互为等电子体的是_______ (填字母)。
A. SCB- B. B2O C. BO2 D.OCB-
(4)E元素的价电子轨道表示式_______ 。
(5)+6价E的化合物毒性较大,常用NaHSO3将酸性废液中的E2O 还原成E3+,反应的离子方程式为
还原成E3+,反应的离子方程式为_______ 。
(6)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为_______ g·cm-3(用NA表示阿伏加德罗常数)。
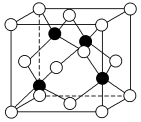
(1)元素B、C、D第一电离能由小到大的顺序为
(2)BC
 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为(3)下列含B元素的微粒与CO2分子不是互为等电子体的是
A. SCB- B. B2O C. BO2 D.OCB-
(4)E元素的价电子轨道表示式
(5)+6价E的化合物毒性较大,常用NaHSO3将酸性废液中的E2O
 还原成E3+,反应的离子方程式为
还原成E3+,反应的离子方程式为(6)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】下图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍。
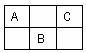
1、(用元素符号表示)A____________ B____________ C____________
2、B的最高价氧化物的化学式___________ ,属于__________ 晶体。
3、C的气态氢化物的化学式_____________ ,其中存在________ 键。

1、(用元素符号表示)A
2、B的最高价氧化物的化学式
3、C的气态氢化物的化学式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】(现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)由表格可知,A组熔点普遍偏高,据此回答:
①A组属于__________ 晶体,其熔化时克服的粒子间的作用力是__________ ;
②硼晶体的硬度________ 硅晶体的硬度(填“大于”“小于”)。
(2)B组中 熔点反常是由于
熔点反常是由于__________ 。
(3)C组晶体中 、
、 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为_________ , 晶体的熔点高于三者,其原因是
晶体的熔点高于三者,其原因是________________ 。
(4)氢化铝钠 是一种新型轻质储氢材料,掺入少量
是一种新型轻质储氢材料,掺入少量 的
的 在150℃时释氢,在170℃、
在150℃时释氢,在170℃、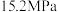 条件下又重复吸氢。
条件下又重复吸氢。 的晶胞结构如图所示:
的晶胞结构如图所示:
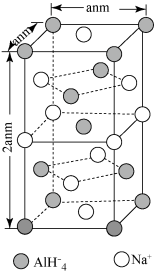
 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有___________ 个; 晶体的密度为
晶体的密度为________  (用含a的代数式表示)。若
(用含a的代数式表示)。若 晶胞底心处的
晶胞底心处的 被
被 取代,得到的晶体为
取代,得到的晶体为_________ (填化学式)。
| A组 | B组 | C组 |
| 金刚石:3550 |  : :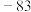 |  |
| 硅晶体:1410 |  : :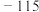 |  |
| 硼晶体:2300 |  : :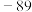 | 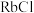 |
| 二氧化硅:1732 |  : :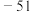 |  :2800℃ :2800℃ |
(1)由表格可知,A组熔点普遍偏高,据此回答:
①A组属于
②硼晶体的硬度
(2)B组中
 熔点反常是由于
熔点反常是由于(3)C组晶体中
 、
、 、
、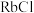 的熔点由高到低的顺序为
的熔点由高到低的顺序为 晶体的熔点高于三者,其原因是
晶体的熔点高于三者,其原因是(4)氢化铝钠
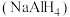 是一种新型轻质储氢材料,掺入少量
是一种新型轻质储氢材料,掺入少量 的
的 在150℃时释氢,在170℃、
在150℃时释氢,在170℃、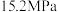 条件下又重复吸氢。
条件下又重复吸氢。 的晶胞结构如图所示:
的晶胞结构如图所示:
 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有 晶体的密度为
晶体的密度为 (用含a的代数式表示)。若
(用含a的代数式表示)。若 晶胞底心处的
晶胞底心处的 被
被 取代,得到的晶体为
取代,得到的晶体为
您最近一年使用:0次
【推荐3】铁及铁的化合物在生产、生活中有广泛应用。回答下列问题:
(1)普鲁士蓝的化学式为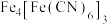 ,其中
,其中 与
与 数目之比为
数目之比为_______ ;1mol该物质中含 键数目为
键数目为_______  。
。
(2)实验室中常用 与
与 形成稳定的红色物质
形成稳定的红色物质 的特性来检验
的特性来检验 的存在。SCN-的空间构型为
的存在。SCN-的空间构型为_______ 。
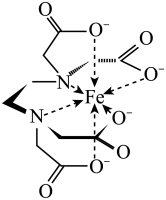
(3)铁强化酱油中常添加NaFeEDTA,其配离子结构如下图,则Fe3+的配位数为_______ 。
(4)三氯化铁在300℃时易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,根据以上信息判断三氯化铁的晶体类型为_______ ,不考虑空间构型,画出三氯化铁双聚分子在400℃时的结构式_______ 。
(5)利用Fe和CO可以合成化工原料配合物 。CO是配位体,提供孤电子对的是C而不是O,其主要原因是
。CO是配位体,提供孤电子对的是C而不是O,其主要原因是_______ 。
(1)普鲁士蓝的化学式为
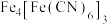 ,其中
,其中 与
与 数目之比为
数目之比为 键数目为
键数目为 。
。(2)实验室中常用
 与
与 形成稳定的红色物质
形成稳定的红色物质 的特性来检验
的特性来检验 的存在。SCN-的空间构型为
的存在。SCN-的空间构型为(3)铁强化酱油中常添加NaFeEDTA,其配离子结构如下图,则Fe3+的配位数为

(4)三氯化铁在300℃时易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,根据以上信息判断三氯化铁的晶体类型为
(5)利用Fe和CO可以合成化工原料配合物
 。CO是配位体,提供孤电子对的是C而不是O,其主要原因是
。CO是配位体,提供孤电子对的是C而不是O,其主要原因是
您最近一年使用:0次



