硼及其化合物在工业上有重要的用途,回答下列问题:
(1)基态硼原子有_______ 个不同运动状态的电子,基态硼原子最高能级的电子排布式为_______ 。
(2)BF3能与多种物质化合。
①气态BF3与无水乙醚可化合生成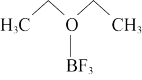 ,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为
,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为_______ 。
②BF3与NH3可形成“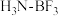 ”分子,其原因是
”分子,其原因是_______ 。
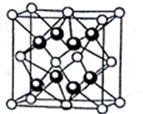
(3)硼原子和磷原子能形成共价晶体磷化硼,其密度为 ,晶胞如图所示:
,晶胞如图所示:
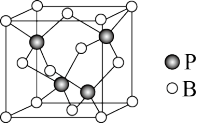
①磷化硼的化学式为_______ 。
②硼原子的配位数为_______ 。
③其晶胞参数a=_______ pm(B的相对原子质量为10.8,P的相对原子质量为31,阿伏加德罗常数的值用 表示)。
表示)。
(1)基态硼原子有
(2)BF3能与多种物质化合。
①气态BF3与无水乙醚可化合生成
 ,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为
,该产物熔点为-58℃,沸点为128℃,据此判断该产物的晶体类型为②BF3与NH3可形成“
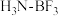 ”分子,其原因是
”分子,其原因是(3)硼原子和磷原子能形成共价晶体磷化硼,其密度为
 ,晶胞如图所示:
,晶胞如图所示:
①磷化硼的化学式为
②硼原子的配位数为
③其晶胞参数a=
 表示)。
表示)。
更新时间:2022-08-22 17:11:22
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】卤素是典型的非金属元素,它们在自然界中大多以盐的形式存在。回答下列问题:
(1)卤素互化物是指两种卤素形成的化合物,因中心原子的成单电子数为奇数,故配体数目也为奇数,如IF7、ICl3、ClF3等。基态溴原子的价电子排布式为________ ,分析上述卤素互化物中中心原子和配体的电负性特点,推测卤素互化物BrXa中,X可能是__________ (填元素符号);
(2)CsBrCl2属于多卤化物,受热分解存在如下两种可能:
CsBrCl2= CsBr+Cl2①
CsBiCl2=CsCl+BrCl ②
由于晶格能的原因,实际进行的是反应②,则晶格能:CsCl________ CsBr。(填“>”或 “<”)
(3)(CN)2、(SCN)2的性质与卤素单质相似,称为拟卤素。其分子内各原子均达到8电子结构,则(CN)2分子中σ键和π键的个数比为___________ ,SCN-离子的空间构型为_______________ 形,C原子的轨道杂化方式为_____________ 。 SCN-离子用于检验Fe3+时,SCN-与Fe3+间形成的化学键为_____________ 键;
(4)一种天然宝石萤石的主要成分是CaF2。下图是CaF2的晶胞结构示意图,其中与每个Ca2+距离最近的Ca2+有__________ 个;该晶胞边长为α cm,晶体密度为________ g•cm-3(用NA表示阿伏伽德罗常数值)。
(1)卤素互化物是指两种卤素形成的化合物,因中心原子的成单电子数为奇数,故配体数目也为奇数,如IF7、ICl3、ClF3等。基态溴原子的价电子排布式为
(2)CsBrCl2属于多卤化物,受热分解存在如下两种可能:
CsBrCl2= CsBr+Cl2①
CsBiCl2=CsCl+BrCl ②
由于晶格能的原因,实际进行的是反应②,则晶格能:CsCl
(3)(CN)2、(SCN)2的性质与卤素单质相似,称为拟卤素。其分子内各原子均达到8电子结构,则(CN)2分子中σ键和π键的个数比为
(4)一种天然宝石萤石的主要成分是CaF2。下图是CaF2的晶胞结构示意图,其中与每个Ca2+距离最近的Ca2+有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为54。X的激发态原子电子排布式为2p1,Y原子的基态原子有3个不同的能级,且各能级中电子数相等,Z的基态原子中有3个未成对电子,W的电离能如下表所示,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)U原子电子排布式为_______________ 。
(2)X与Z 形成的化合物Z2X4,Z原子采取的杂化轨道类型为_______ ,Y的最高价氧化物的水化物的正盐的阴离子的空间构型为_______ ;
(3)W的氯化物和Mg的氯化物中,熔点较高的是________ (填化学式),原因是_______ 。
(4)I4O9由一种阳离子和一种阴离子按物质的量比1:3构成,阴离子的空间构型为三角锥形,中心原子杂化类型为sp3杂化,写出I4O9的电离方程式______ 。
(5)Nb(黑球)和I(白球)能形成一种线性的无机高分子化合物,其结构是许多八面体通过棱边而联结起来的长链,如下图所示。则该化合物中Nb和I的原子个数比为______ 。

| 元素 | 第一电离能 | 第二电离能 | 第三电离能 |
| W | 495.8 | 4562 | 6910.3 |
(2)X与Z 形成的化合物Z2X4,Z原子采取的杂化轨道类型为
(3)W的氯化物和Mg的氯化物中,熔点较高的是
(4)I4O9由一种阳离子和一种阴离子按物质的量比1:3构成,阴离子的空间构型为三角锥形,中心原子杂化类型为sp3杂化,写出I4O9的电离方程式
(5)Nb(黑球)和I(白球)能形成一种线性的无机高分子化合物,其结构是许多八面体通过棱边而联结起来的长链,如下图所示。则该化合物中Nb和I的原子个数比为

您最近一年使用:0次
【推荐3】【化学——选修3:物质结构与性质】过渡金属元素铁能形成多种配合物,如:K3[Fe(SCN)6][硫氰合铁(Ⅲ)酸钾]和Fe(CO)x等。
(1)①基态Fe3+的M层电子排布式为___________________________ 。
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因______________ 。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x =____ 。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为_________________ 。

(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为_______________________ 。
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有_____ 个π电子。
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的是__________ 结构(填“重叠”或“错位”)。
(1)①基态Fe3+的M层电子排布式为
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x =
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为

(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】铜、镍单质及其化合物是化工生产、生活中常用的材料。回答下列问题:
(1)Ni基态原子核外电子排布式为____ 。
(2)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为____ ,其中N原子的杂化轨道类型为____ 。
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角____ (填“大”“小”或“相等”)。
③1mol[Cu(NH3)4]2+中存在____ 个σ键(用NA表示)。
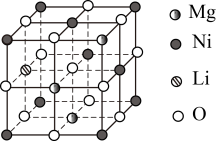
(3)已知NixMg1-xO晶体属于立方晶系,晶胞边长为a。将Li+掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示,该物质的化学式为____ 。
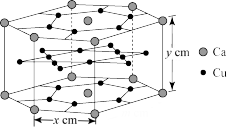
(4)一种Ca、Cu形成的金属互化物的晶体结构如图所示,设阿伏加德罗常数的值为NA,则该金属互化物的密度是____ g·cm-3(列出表达式即可)。
(1)Ni基态原子核外电子排布式为
(2)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角
③1mol[Cu(NH3)4]2+中存在
(3)已知NixMg1-xO晶体属于立方晶系,晶胞边长为a。将Li+掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示,该物质的化学式为

(4)一种Ca、Cu形成的金属互化物的晶体结构如图所示,设阿伏加德罗常数的值为NA,则该金属互化物的密度是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
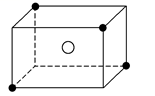
【推荐2】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__ 个X,每个X同时吸引着__ 个Y,该晶体的化学式为____________ 。
(2)晶体中每个X周围与它最接近且距离相等的X共有___ 个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____ 。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___ cm。
(1)晶体中每个Y同时吸引着
(2)晶体中每个X周围与它最接近且距离相等的X共有
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)有下列六种物质:①C60晶体 ②金刚石 ③Na2O晶体 ④CaF2晶体 ⑤P4O10晶体 ⑥碳化硅晶体。其中属于离子晶体的是___________ (填序号,下同),属于分子晶体的是___________ 。
(2)铜及其化合物在日常生产、生活中有着广泛的应用。
①向盛有硫酸铜溶液的试管里加入氨水,先形成难溶物;继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,请写出难溶物溶解过程中发生反应的离子方程式_______________ ;再加入乙醇,析出深蓝色晶体。下列对此现象说法正确的是___________
A.深蓝色溶液中的Cu2+的浓度与硫酸铜溶液中的Cu2+浓度相同
B.深蓝色晶体中的阴阳离子构型都为正四面体形
C.[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3分子中的N原子提供孤对电子
D.加入乙醇后,能析出深蓝色晶体,是因为乙醇的极性较大
E.NH3与Cu2+形成的配位键比H2O与Cu2+形成的配位键更稳定
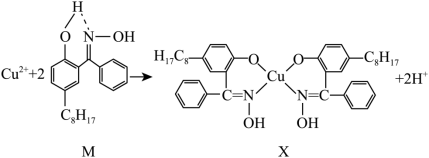
②含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。___________ 。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
③一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于晶胞顶点;该晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 (见下图)的结构相似,该晶体储氢后的化学式应为
(见下图)的结构相似,该晶体储氢后的化学式应为___________ 。
(1)有下列六种物质:①C60晶体 ②金刚石 ③Na2O晶体 ④CaF2晶体 ⑤P4O10晶体 ⑥碳化硅晶体。其中属于离子晶体的是
(2)铜及其化合物在日常生产、生活中有着广泛的应用。
①向盛有硫酸铜溶液的试管里加入氨水,先形成难溶物;继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,请写出难溶物溶解过程中发生反应的离子方程式
A.深蓝色溶液中的Cu2+的浓度与硫酸铜溶液中的Cu2+浓度相同
B.深蓝色晶体中的阴阳离子构型都为正四面体形
C.[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3分子中的N原子提供孤对电子
D.加入乙醇后,能析出深蓝色晶体,是因为乙醇的极性较大
E.NH3与Cu2+形成的配位键比H2O与Cu2+形成的配位键更稳定
②含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
③一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于晶胞顶点;该晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与
 (见下图)的结构相似,该晶体储氢后的化学式应为
(见下图)的结构相似,该晶体储氢后的化学式应为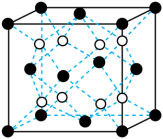
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮是生命物质的重要组成元素之一,氮及其化合物与我们的生产、科研密切相关。
(1)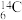 通过衰变反应可获得
通过衰变反应可获得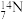 。
。
①基态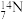 原子的价电子排布图为
原子的价电子排布图为___ ,其核外电子有__ 种运动状态。
②第二周期元素的第一电离能介于C、N之间的为___ (填元素符号)。
(2)某科研机构曾预想合成一个纯粹由氮组成的新物种——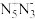 ,以取代有毒的肼类火箭燃料。
,以取代有毒的肼类火箭燃料。 的空间构型为
的空间构型为___ 。
(3)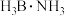 是一种有效、安全的固体储氢材料,可由
是一种有效、安全的固体储氢材料,可由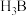 与
与 反应生成,B与N之间形成配位键,氮原子提供
反应生成,B与N之间形成配位键,氮原子提供___ ,在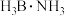 中B原子的杂化方式为
中B原子的杂化方式为___ 。
(4)在高压下氮气会发生聚合得到高聚氮,这种高聚氮晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构。该晶体的结构片段如图所示:
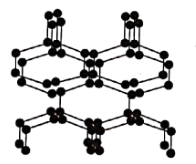
高聚氮晶体属于_____ 晶体,高聚氮晶体中n(N):n(N-N)=____ 。
(1)
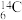 通过衰变反应可获得
通过衰变反应可获得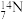 。
。①基态
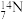 原子的价电子排布图为
原子的价电子排布图为②第二周期元素的第一电离能介于C、N之间的为
(2)某科研机构曾预想合成一个纯粹由氮组成的新物种——
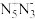 ,以取代有毒的肼类火箭燃料。
,以取代有毒的肼类火箭燃料。 的空间构型为
的空间构型为(3)
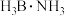 是一种有效、安全的固体储氢材料,可由
是一种有效、安全的固体储氢材料,可由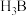 与
与 反应生成,B与N之间形成配位键,氮原子提供
反应生成,B与N之间形成配位键,氮原子提供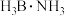 中B原子的杂化方式为
中B原子的杂化方式为(4)在高压下氮气会发生聚合得到高聚氮,这种高聚氮晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构。该晶体的结构片段如图所示:

高聚氮晶体属于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:
(1)基态Br原子的电子排布式为[Ar]____ 。
(2)HF分子的极性____ (填“大于”“等于”或“小于”,以下同)HCl,同一条件下,HF在水中的溶解度____ HCl,HF的沸点____ HCl。SOCl2中心S原子VSEPR模型为____ 。1mol氟硼酸铵NH4BF4中含有____ mol配位键。
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为____ ,距离Hg最近的Ag有____ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg•mol-1,该晶体的密度为____ g•cm-3(用代数式表示)。

(1)基态Br原子的电子排布式为[Ar]
(2)HF分子的极性
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】回收钴废料能有效缓解金属资源浪费、环境污染等问题。一种以含钴催化剂废料(主要含Co、Fe,还含有少量的CoO、FeO、 、CaO、
、CaO、 )制备氧化钴(Co2O3)的工艺流程如下图所示:
)制备氧化钴(Co2O3)的工艺流程如下图所示:
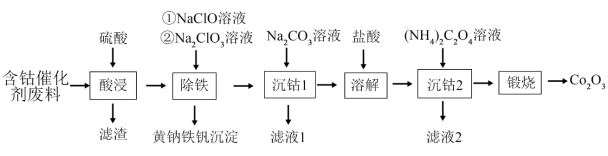
已知:i.金属钴与铁具有相似的化学性质;
ii.氧化性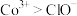 。
。
回答下列问题:
(1)酸浸后,“滤渣”的主要成分有_______ 和_______ (填化学式)。
(2)基态钴原子的价电子排布式为_______ 。
(3)已知CoO的熔点(1785℃)高于FeO的熔点(1369℃),其原因是_______ 。
(4)“除铁”时加入NaClO,主要反应的离子方程式为_______ ,再加入 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
(5) 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ 。 中除氢元素外,其他元素电负性由大到小的顺序为
中除氢元素外,其他元素电负性由大到小的顺序为_______ 。
(6)“滤液2”中主要溶质的常见用途为_______ 。
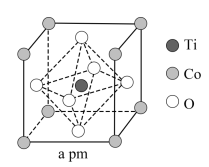
(7)所得 可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为
可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为_______ 个。设 为阿伏加德罗常数的值,该钛酸钴晶体的密度为
为阿伏加德罗常数的值,该钛酸钴晶体的密度为_______  (列出计算式)。
(列出计算式)。
 、CaO、
、CaO、 )制备氧化钴(Co2O3)的工艺流程如下图所示:
)制备氧化钴(Co2O3)的工艺流程如下图所示:
已知:i.金属钴与铁具有相似的化学性质;
ii.氧化性
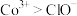 。
。回答下列问题:
(1)酸浸后,“滤渣”的主要成分有
(2)基态钴原子的价电子排布式为
(3)已知CoO的熔点(1785℃)高于FeO的熔点(1369℃),其原因是
(4)“除铁”时加入NaClO,主要反应的离子方程式为
 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。(5)
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为 中除氢元素外,其他元素电负性由大到小的顺序为
中除氢元素外,其他元素电负性由大到小的顺序为(6)“滤液2”中主要溶质的常见用途为
(7)所得
 可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为
可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为 为阿伏加德罗常数的值,该钛酸钴晶体的密度为
为阿伏加德罗常数的值,该钛酸钴晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________ ,该元素基态原子核外M层电子的自旋状态_________ (填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________ ,其中Fe的配位数为_____________ 。
(3)苯胺 )的晶体类型是
)的晶体类型是__________ 。苯胺与甲苯(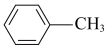 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________ 。
(4)NH4H2PO4中,电负性最高的元素是______ ;P的_______ 杂化轨道与O的2p轨道形成_______ 键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
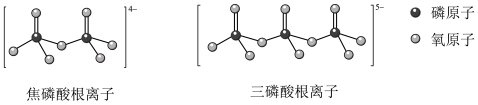
这类磷酸根离子的化学式可用通式表示为____________ (用n代表P原子数)。
(1)在周期表中,与Li的化学性质最相似的邻族元素是
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(3)苯胺
 )的晶体类型是
)的晶体类型是 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是(4)NH4H2PO4中,电负性最高的元素是
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题:
I、铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置_______ ,属于_______ 区;Fe原子的价层电子排布图为_______ 。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:
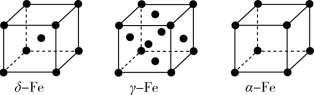
①α—Fe晶体中每个铁原子周围与它最接近且距离相等的铁原子有_______ 个。
②γ—Fe晶体晶胞中所含有的铁原子数为_______ 。
③若δ—Fe晶体的晶胞边长为a cm, 表示阿伏加德罗常数的值,则δ—Fe单质的密度为
表示阿伏加德罗常数的值,则δ—Fe单质的密度为_______  (列出算式即可)。
(列出算式即可)。
II、利用离子液体[EMIM][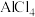 ]可电沉积还原金属Ge,其熔点只有7℃,其中
]可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。
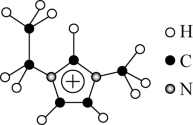
(3)该物质的晶体类型是_______ 。
(4) 离子中组成元素的电负性由小到大的顺序是
离子中组成元素的电负性由小到大的顺序是_______
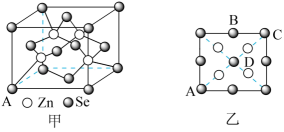
III、硒化锌(ZnSe)是一种重要的半导体材料:
(5)其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为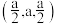 ,则D点坐标为
,则D点坐标为_______ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为_______ (只列出计算式)。
I、铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:

①α—Fe晶体中每个铁原子周围与它最接近且距离相等的铁原子有
②γ—Fe晶体晶胞中所含有的铁原子数为
③若δ—Fe晶体的晶胞边长为a cm,
 表示阿伏加德罗常数的值,则δ—Fe单质的密度为
表示阿伏加德罗常数的值,则δ—Fe单质的密度为 (列出算式即可)。
(列出算式即可)。II、利用离子液体[EMIM][
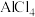 ]可电沉积还原金属Ge,其熔点只有7℃,其中
]可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。
(3)该物质的晶体类型是
(4)
 离子中组成元素的电负性由小到大的顺序是
离子中组成元素的电负性由小到大的顺序是III、硒化锌(ZnSe)是一种重要的半导体材料:
(5)其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为
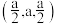 ,则D点坐标为
,则D点坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)
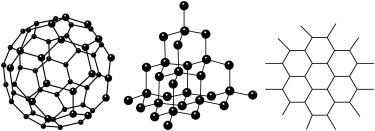
(1)C60、金刚石和石墨三者的关系互为_________
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于__________ 晶体(填“离子”、“原子”或“分子”)。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅的单键的数目约是________ NA个。二氧化硅的结构相当于在硅晶体结构中每个硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅氧原子形成的最小环上氧原子的数目是__________ 。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是__________ 。

(1)C60、金刚石和石墨三者的关系互为
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅的单键的数目约是
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是
您最近一年使用:0次



