名校
解题方法
1 . 下列有关说法正确的是
| A.电子云通常用小点的疏密来表示,小点密表示在该空间的电子数多 |
B.已知 的价电子排布式为 的价电子排布式为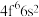 , , 的价电子排布式为 的价电子排布式为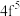 |
C. 的核外电子排布式为 的核外电子排布式为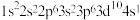 ,所以 ,所以 位于s区 位于s区 |
D.原子光谱的特征谱线用于鉴定元素,从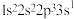 跃迁至 跃迁至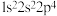 时吸收能量 时吸收能量 |
您最近一年使用:0次
2021-02-15更新
|
365次组卷
|
6卷引用:湖北省孝感市2019-2020学年高二上学期期末质量联合检测化学试题
名校
2 . FeSe、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________ ,基态Se原子的电子占据最高能级的电子云轮廓图为________ 形。
(2)向FeSe中嵌入吡啶(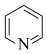 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________ ;该分子内存在________ (填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________ 。
②液氨是氨气液化的产物,氨气易液化的原因是________ 。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________ 。
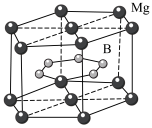
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________ 个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏伽德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)向FeSe中嵌入吡啶(
 )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为
②液氨是氨气液化的产物,氨气易液化的原因是
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有
您最近一年使用:0次
2019-03-02更新
|
407次组卷
|
4卷引用:【市级联考】广东省广州市2019届高三上学期期末调研测试理科综合化学试题
名校
解题方法
3 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____ 区元素,其基态原子的价电子排布式为_____ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为____ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____ (用元素符号表示)。
(4)CO32-的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________ ,1mol碳酸丙烯酯中键的数目为________ .
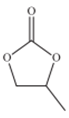
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____ ,该配离子包含的作用力为__ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
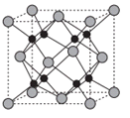
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏伽德罗常数的值为NA,则Na与O之间的最短距离为_____ cm(用含ρ、NA的代数式表示)。
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为
(4)CO32-的几何构型为

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
2018-04-27更新
|
459次组卷
|
5卷引用:【市级联考】江西省宜春市2019届高三上学期期末统考理科综合化学试题
9-10高二下·辽宁大连·期末
名校
4 . 下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移的是
| A.BeCl2 | B.PCl3 | C.PCl5 | D.N2 |
您最近一年使用:0次
2017-06-09更新
|
279次组卷
|
9卷引用:2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷
(已下线)2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷(已下线)09-10年辽宁大连23中高二下学期期末考试化学卷(已下线)2011--2012学年四川省成都二十中高二上学期期中考试化学试卷(已下线)2012年人教版高中化学选修3 2.3分子的性质练习卷(已下线)2012-2013学年四川省南充高中高二上学期期中考试文科化学试卷陕西省黄陵中学2016-2017学年高二(重点班)下学期第三学月考化学试题上海交通大学附属中学2017-2018学年高一上学期末考化学试题山西省忻州市第二中学2019-2020高二下学期3月考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)
5 . 下列叙述错误的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq)△H=﹣114.6kJ·mol﹣1 则中和热为57.3kJ·mol﹣1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq)△H=﹣114.6kJ·mol﹣1 则中和热为57.3kJ·mol﹣1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
| A.②④⑥ | B.①⑤⑥ | C.①⑤⑦ | D.②③④ |
您最近一年使用:0次
2016-12-09更新
|
257次组卷
|
8卷引用:2016届江西省上高二中高三全真模拟理综化学试卷
名校
6 . 在1~18元素的原子中,核外电子能量最低的电子层是
| A.K | B.L | C.M | D.N |
您最近一年使用:0次
2016-12-09更新
|
327次组卷
|
3卷引用:江西省宜春市宜丰县二中2020届高三上学期第一次月考化学试题



