1 . M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)X原子的结构示意图为:___________ ,其核外电子运动状态共有___________ 种,Z的基态原子的价电子排布式为___________ 。
(2)写出M与R形成含有非极性键的离子化合物的电子式___________ 。
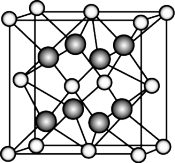
(3)M和R所形成的一种离子化合物晶体的晶胞如图所示,则该离子化合物的化学式是___________ ,该物质与水反应的化学方程式为:___________ 。
(4)在稀硫酸中,Z的最高价含氧酸的钾盐(K2Z2O7橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的离子方程式是___________ 。
(1)X原子的结构示意图为:
(2)写出M与R形成含有非极性键的离子化合物的电子式
(3)M和R所形成的一种离子化合物晶体的晶胞如图所示,则该离子化合物的化学式是

(4)在稀硫酸中,Z的最高价含氧酸的钾盐(K2Z2O7橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的离子方程式是
您最近一年使用:0次
2 . 现有七种元素,其中A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式___________ ;
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈_________ 形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为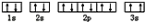 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了___________ ;
(4)G位于____ 族__ 区,价电子排布式为___________ ;
(5)DE3中心原子的杂化方式为___________ ,用价层电子对互斥理论推测其空间构型为___________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kT/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布为
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(4)G位于
(5)DE3中心原子的杂化方式为
您最近一年使用:0次
名校
3 . 在短周期元素中,元素的基态原子核外未成对电子数等于能层序数的元素有a种,元素的基态原子最外层电子数是未成对电子数2倍的元素有b种,则 的值为
的值为
 的值为
的值为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2021-02-16更新
|
2320次组卷
|
11卷引用:(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构
(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构 课时3 泡利原理、洪特规则和能量最低原理吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)吉林省通化市2021-2022学年高二下学期期中联考化学试题广西钦州市第四中学2022-2023学年高二下学期2月考试化学试题第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)第1讲 原子结构 核外电子排布辽宁省东北育才学校科学高中部2023-2024学年高二上学期第二次月考化学试题(已下线)热点01 原子结构
名校
解题方法
4 . 铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________ 对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________ I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________ ;
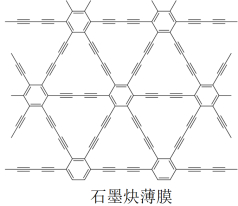
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________ 的杂化方式。
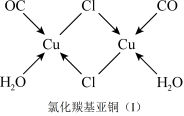
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________ σ键数目。
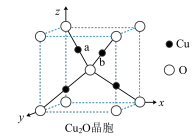
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为________________ ;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________ 。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________ (填“高”或“低”),请解释原因___________________ 。
(1)基态铜原子核外有
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子



(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的
您最近一年使用:0次
2020-04-02更新
|
308次组卷
|
3卷引用:山东省潍坊市2020届高三下学期第三次线上检测化学试题



