名校
1 . 硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)B元素的基态原子的价电子排布图为_____ ,第二周期中第一电离比B小的元素为______ 。
(2)三氟化硼常用作有机反应的催化剂,其分子的立体构型为______ ,中心原子的杂化类型为________ 。
(3)B的一种天然矿藏化学式为Na2[B4O5(OH)4]·8H2O,其阴离子结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,结构式如图1,该阴离子含配位键,请在下图中用“→”标出其中的配位键。该阴离子可相互结合形成链状结构,其可能的原因是___________ 。

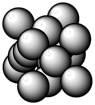
(4)科学家发现硼化镁在39K时有超导性,理想的硼化镁晶体是镁原子和硼原子是分层排布,即一层镁一层硼相间排列。下图是该晶体微观结构中取出的部分原子沿z轴方向的投影(白球是镁,黑球是硼)。则硼化镁的化学式为___________ 。
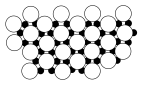
(5)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的___ (选填“立方体”“正四面体”或“正八面体”)空隙。建立如图所示坐标系,可得晶胞中A、C处原子的分数坐标,则M,N处的P原子分数坐标分别为_________ ,_________ ,若晶胞中硼原子和磷原子之间的最近核间距为apm,则晶胞边长为___________ cm。
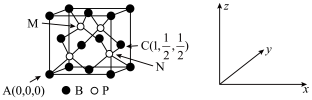
(1)B元素的基态原子的价电子排布图为
(2)三氟化硼常用作有机反应的催化剂,其分子的立体构型为
(3)B的一种天然矿藏化学式为Na2[B4O5(OH)4]·8H2O,其阴离子结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,结构式如图1,该阴离子含配位键,请在下图中用“→”标出其中的配位键。该阴离子可相互结合形成链状结构,其可能的原因是

(4)科学家发现硼化镁在39K时有超导性,理想的硼化镁晶体是镁原子和硼原子是分层排布,即一层镁一层硼相间排列。下图是该晶体微观结构中取出的部分原子沿z轴方向的投影(白球是镁,黑球是硼)。则硼化镁的化学式为

(5)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的

您最近一年使用:0次
解题方法
2 . 【化学—选修3:物质结构与性质】
铁、铝、铜都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
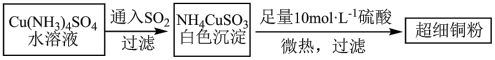
①铜元素位于周期表_________ 区;Cu+的基态价电子排布图_________ ;NH4CuSO3中N、S、O三种元素的第一电离能由大到小的顺序为_________ (元素符号表示)。
②SO42-中心原子的杂化方式为_________ ,SO32-的价层电子互斥模型为_________ 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式_________ 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是_________ 。
a.因NH3和H2O都为极性分子,且它们还存在分子内氢键,所以氨气极易溶于水
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_________ 。
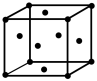
(4)下图所示为金属铜的一个晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则晶胞中铜原子的配位数为_________ ,用含有a、ρ的代数式表示的阿伏伽德罗常数为:_________ mol-1。
铁、铝、铜都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
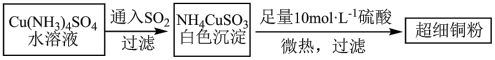
①铜元素位于周期表
②SO42-中心原子的杂化方式为
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.因NH3和H2O都为极性分子,且它们还存在分子内氢键,所以氨气极易溶于水
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因
(4)下图所示为金属铜的一个晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则晶胞中铜原子的配位数为
您最近一年使用:0次



