名校
解题方法
1 . 硼、氮、镁、铝是重要的短周期元素,它们能形成多种重要的化合物。请回答下列问题:
(1)基态Al原子处于最高能级的电子云轮廓图为_______ 形,基态 的核外电子的轨道表达式为
的核外电子的轨道表达式为_______ 。
(2)硼的氢化物叫硼烷( ),如
),如 (乙硼烷)。
(乙硼烷)。 与
与 反应生成
反应生成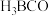 ,
,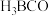 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。
(3)离子化合物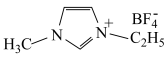 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
①图A、B、C分别表示C、N、O、F的逐级电离能I的变化趋势(纵坐标的标度不同),第一电离能 的变化图是
的变化图是_______ (填序号,下同);第三电离能 的变化图是
的变化图是_______ 。 、
、 和
和 在小立方体中的分布如图2、图3所示。
在小立方体中的分布如图2、图3所示。 的配位数为
的配位数为_______ ,晶体的化学式为_______ 。
②已知 之间的最小间距apm,晶体的密度为d
之间的最小间距apm,晶体的密度为d ,则阿伏加德罗常数的表达式为
,则阿伏加德罗常数的表达式为_______  (用含a、d的式子表示)。
(用含a、d的式子表示)。
(1)基态Al原子处于最高能级的电子云轮廓图为
 的核外电子的轨道表达式为
的核外电子的轨道表达式为(2)硼的氢化物叫硼烷(
 ),如
),如 (乙硼烷)。
(乙硼烷)。 与
与 反应生成
反应生成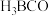 ,
,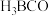 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为(3)离子化合物
 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①图A、B、C分别表示C、N、O、F的逐级电离能I的变化趋势(纵坐标的标度不同),第一电离能
 的变化图是
的变化图是 的变化图是
的变化图是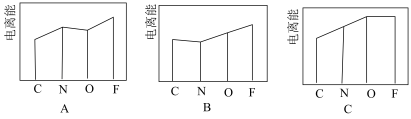
②离子化合物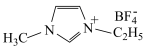 中阳离子存在大
中阳离子存在大 键
键 ,该化合物中杂化方式为
,该化合物中杂化方式为 的原子共有
的原子共有
 、
、 和
和 在小立方体中的分布如图2、图3所示。
在小立方体中的分布如图2、图3所示。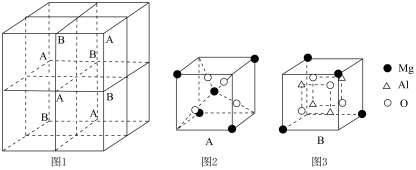
 的配位数为
的配位数为②已知
 之间的最小间距apm,晶体的密度为d
之间的最小间距apm,晶体的密度为d ,则阿伏加德罗常数的表达式为
,则阿伏加德罗常数的表达式为 (用含a、d的式子表示)。
(用含a、d的式子表示)。
您最近一年使用:0次
解题方法
2 . 钴(Co)和铜(Cu)是生命体必需的微量元素,且在材料、医药等领域具有广泛应用。回答下列问题:
(1)Cu-Ni-Co-Si合金具有较高的导电、导热性和良好的加工、耐蚀性,是很有发展潜力的材料。
①基态Cu原子的最外层电子轨道表示式为___________ 。
②电解熔融的CoCl2或CoO都能制备金属钴。CoCl2的熔点(735℃)低于CoO的熔点(1935℃)的原因是___________ 。
(2)含金属钴和一氧化碳配体的羧基钴配合物具有抗肿瘤和抗炎的潜力。一种羰基钴配合物的合成路线如下:___________ 。固体I中存在的作用力除共价键外,还有___________ 。1mol I中含有的σ键数目为___________ 。
②化合物Ⅱ分子中原子的杂化方式有___________ 。
③配合物Ⅲ中,配体一氧化碳的配位原子为___________ ,写出一个与CO互为等电子体的阴离子___________ 。
(3)Cu-Mn-Al合金的晶胞如a图所示,该晶胞可视为Mn,Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。___________ 。
②已知原子半径: ,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为
,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为___________ pm。
(1)Cu-Ni-Co-Si合金具有较高的导电、导热性和良好的加工、耐蚀性,是很有发展潜力的材料。
①基态Cu原子的最外层电子轨道表示式为
②电解熔融的CoCl2或CoO都能制备金属钴。CoCl2的熔点(735℃)低于CoO的熔点(1935℃)的原因是
(2)含金属钴和一氧化碳配体的羧基钴配合物具有抗肿瘤和抗炎的潜力。一种羰基钴配合物的合成路线如下:

②化合物Ⅱ分子中原子的杂化方式有
③配合物Ⅲ中,配体一氧化碳的配位原子为
(3)Cu-Mn-Al合金的晶胞如a图所示,该晶胞可视为Mn,Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。

②已知原子半径:
 ,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为
,r(Al)=143pm,则该晶胞中Cu原子之间的最短核间距为
您最近一年使用:0次
名校
解题方法
3 . 稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第ⅢB族,均为金属元素,在工业生产中有重要的作用。回答下列问题:
(1)基态钪(Sc)元素的原子核外电子占据的轨道数目共_____ 个,钇(Y)位于元素周期表中钪(Sc)的下一周期,钇(Y)的价电子轨道表达式为_____ 。
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA( )是
)是_____ 齿配位体,EDTA所含元素原子第一电离能由大到小顺序为_____ 。
(3)钪(Sc)离子在水中以稳定对称的 存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为
存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为_____ 。
(4)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中铜原子的杂化类型为_____ (填“ ”或“
”或“ ”)。
”)。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是_____ 。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇( )的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
)的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
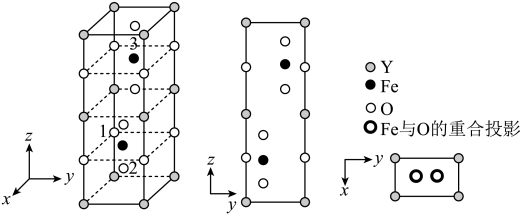
一个晶胞中有_____ 个O。已知1号O原子分数坐标为 ,2号O原子分数坐标为
,2号O原子分数坐标为 ,则3号Fe原子的分数坐标为
,则3号Fe原子的分数坐标为_____ 。
(1)基态钪(Sc)元素的原子核外电子占据的轨道数目共
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(
 )是
)是(3)钪(Sc)离子在水中以稳定对称的
 存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为
存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为(4)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中铜原子的杂化类型为
 ”或“
”或“ ”)。
”)。②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇(
 )的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
)的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
一个晶胞中有
 ,2号O原子分数坐标为
,2号O原子分数坐标为 ,则3号Fe原子的分数坐标为
,则3号Fe原子的分数坐标为
您最近一年使用:0次
解题方法
4 . 有机阳离子是一类带正电荷的粒子,如 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。
(1)C原子价电子的轨道表示式为________ 。第一电离能N____ O(填“>”或“<”),原因是__________ 。
(2) 中N的杂化方式为
中N的杂化方式为____________________ 。从化学键的角度描述由 (甲胺)形成
(甲胺)形成 的过程
的过程____________________ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为__________ 。
(4)某材料中含有机阳离子,其晶胞结构如图所示。
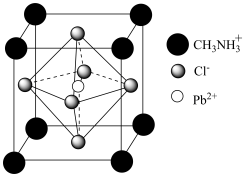
①化学式为____________________ ;其中 周围最临近的
周围最临近的 个数为
个数为__________ 。
②已知晶体密度为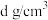 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为______  。
。
 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。(1)C原子价电子的轨道表示式为
(2)
 中N的杂化方式为
中N的杂化方式为 (甲胺)形成
(甲胺)形成 的过程
的过程(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为(4)某材料中含有机阳离子,其晶胞结构如图所示。

①化学式为
 周围最临近的
周围最临近的 个数为
个数为②已知晶体密度为
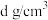 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
名校
5 . 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗等领域。
(1)基态Ti原子的价电子轨道表示式是______ 。
(2) 与
与 互为等电子体,
互为等电子体, 与
与 甲基咪唑
甲基咪唑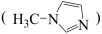 反应可以得到
反应可以得到
 其结构如下图所示。
其结构如下图所示。
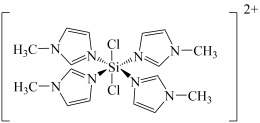
① 分子的空间构型为
分子的空间构型为______ 。
② 甲基咪唑分子中碳原子的杂化轨道类型为
甲基咪唑分子中碳原子的杂化轨道类型为______ ,C、N、Si的电负性由大到小的顺序为______ ,1个 中含有
中含有______ 个σ键。
③ 稳定性比
稳定性比 差,试从化学键角度分析原因:
差,试从化学键角度分析原因:______ 。
(3) 属于四方晶系,晶胞棱边夹角均为90°。研究表明,
属于四方晶系,晶胞棱边夹角均为90°。研究表明, 通过氮掺杂反应可生成
通过氮掺杂反应可生成 ,能使
,能使 对可见光具有活性,反应如图所示。
对可见光具有活性,反应如图所示。
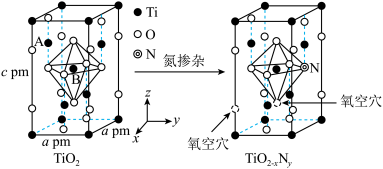
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知上述晶胞中所有 键键长为rpm,B点钛原子分数坐标为
键键长为rpm,B点钛原子分数坐标为 ,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为(
,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为( ,0,
,0,______ )。若 晶体密度为
晶体密度为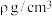 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
______ 。
② 晶体中
晶体中
______ 。
(1)基态Ti原子的价电子轨道表示式是
(2)
 与
与 互为等电子体,
互为等电子体, 与
与 甲基咪唑
甲基咪唑 反应可以得到
反应可以得到
 其结构如下图所示。
其结构如下图所示。
①
 分子的空间构型为
分子的空间构型为②
 甲基咪唑分子中碳原子的杂化轨道类型为
甲基咪唑分子中碳原子的杂化轨道类型为 中含有
中含有③
 稳定性比
稳定性比 差,试从化学键角度分析原因:
差,试从化学键角度分析原因:(3)
 属于四方晶系,晶胞棱边夹角均为90°。研究表明,
属于四方晶系,晶胞棱边夹角均为90°。研究表明, 通过氮掺杂反应可生成
通过氮掺杂反应可生成 ,能使
,能使 对可见光具有活性,反应如图所示。
对可见光具有活性,反应如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知上述晶胞中所有
 键键长为rpm,B点钛原子分数坐标为
键键长为rpm,B点钛原子分数坐标为 ,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为(
,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为( ,0,
,0, 晶体密度为
晶体密度为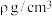 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
②
 晶体中
晶体中
您最近一年使用:0次
6 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.已知 为正盐,可知 为正盐,可知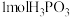 含羟基数为 含羟基数为 |
B.1mol基态碳原子核外电子占据的原子轨道数目为 |
C.58g正丁烷和异丁烷的混合物中共价键数目为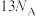 |
D.一定条件下,足量氧气通过Na单质后,若固体增重3.2g,则转移的电子数一定为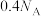 |
您最近一年使用:0次
名校
解题方法
7 . 阿尔维德卡尔森因发现多巴胺获得了2000年诺贝尔生理学或医学奖,多巴胺是一种神经传导物质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物也能传递兴奋及开心的信息。其结构式如下图a所示,化学式为C8H11NO2。回答下列问题:
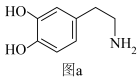
(1)基态氧原子最高能级上有_______ 种运动状态不同的电子,基态碳原子的一个2s电子跃迁到2p轨道形成激发态原子的价电子排布图为_______ 。
(2)多巴胺分子中碳原子的杂化方式有_______ ,C、N、O的第一电离能由大到小的顺序为_______ 。
(3)1 mol多巴胺中含有 键的数目为
键的数目为_______ 。多巴胺易溶于水,理由是_______ 。
(4)多巴胺与盐酸作用能形成盐酸多巴胺,结构如上图b所示,多巴胺和盐酸多巴胺中H—N—H键的键角,前者_______ (填“大于”“等于”或“小于”)后者,理由是_______ 。
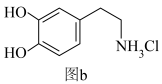
(5)盐酸多巴胺形成的晶体的晶胞结构如图所示,其晶胞中阳离子为面心立方最密堆积,阳离子半径为R pm,则晶胞氯离子的配位数是_______ ,晶胞的密度是_______ 。


(1)基态氧原子最高能级上有
(2)多巴胺分子中碳原子的杂化方式有
(3)1 mol多巴胺中含有
 键的数目为
键的数目为(4)多巴胺与盐酸作用能形成盐酸多巴胺,结构如上图b所示,多巴胺和盐酸多巴胺中H—N—H键的键角,前者

(5)盐酸多巴胺形成的晶体的晶胞结构如图所示,其晶胞中阳离子为面心立方最密堆积,阳离子半径为R pm,则晶胞氯离子的配位数是

您最近一年使用:0次
2023-12-31更新
|
323次组卷
|
3卷引用:2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题
名校
解题方法
8 . 氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(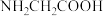 )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
(1)
 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为a. b.
b.  c.
c.  d.
d.
(2)
 和
和 分子中均含有以N原子为中心原子的大
分子中均含有以N原子为中心原子的大 健
健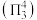 。
。 分子中
分子中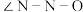
 分子中
分子中 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
(3)甘氨酸的晶体类型为
(4)三价铁的强酸盐溶于水后经水解可以生成如下图1所示的二聚体,其中
 的配位数为
的配位数为 、②
、② 、③
、③ ,该二聚体中Fe采取的杂化类型为
,该二聚体中Fe采取的杂化类型为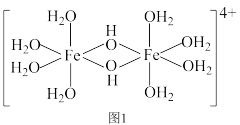
(5)碳有多种同素异形体如石墨和金刚石。石墨结构如上图2所示,金刚石晶胞如上图3所示,其中碳碳键的键长石墨
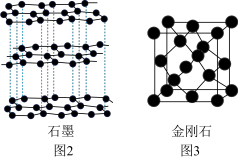
您最近一年使用:0次
2023-11-21更新
|
552次组卷
|
3卷引用:2024届四川省内江市威远中学校高三下学期第一次模拟考试理科综合试题-高中化学
解题方法
9 . 硫是组成生命的重要元素。回答下列问题:
(1)基态S原子含有___________ 种能量不同的电子,其价层电子排布图是___________ 。
(2)S单质的常见形式为 (
(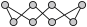 ),其中S原子采用的轨道杂化方式是
),其中S原子采用的轨道杂化方式是___________ 。
(3)已知化合物 (
( )中键角α为124°,β为96°,α>β的原因主要是
)中键角α为124°,β为96°,α>β的原因主要是___________ 。
(4) 的结构简图如图所示,其中不存在的作用力有
的结构简图如图所示,其中不存在的作用力有___________ (填字母)。
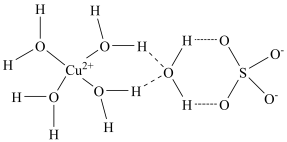
A.氢键 B.共价键 C.金属键 D.配位键
 的空间构型是
的空间构型是___________ ,写出一个与 互为等电子体的阴离子的化学式
互为等电子体的阴离子的化学式___________ 。
(5)ZnS在光导体材料、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶体密度为 ,若将a位置
,若将a位置 离子的分数坐标确定为(0,0,0),则b位置
离子的分数坐标确定为(0,0,0),则b位置 离子的分数坐标为
离子的分数坐标为___________ , 离子与
离子与 离子的最近距离为
离子的最近距离为___________ pm(列出计算式,阿伏加德罗常数用 表示)。
表示)。

(1)基态S原子含有
(2)S单质的常见形式为
 (
( ),其中S原子采用的轨道杂化方式是
),其中S原子采用的轨道杂化方式是(3)已知化合物
 (
( )中键角α为124°,β为96°,α>β的原因主要是
)中键角α为124°,β为96°,α>β的原因主要是(4)
 的结构简图如图所示,其中不存在的作用力有
的结构简图如图所示,其中不存在的作用力有
A.氢键 B.共价键 C.金属键 D.配位键
 的空间构型是
的空间构型是 互为等电子体的阴离子的化学式
互为等电子体的阴离子的化学式(5)ZnS在光导体材料、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶体密度为
 ,若将a位置
,若将a位置 离子的分数坐标确定为(0,0,0),则b位置
离子的分数坐标确定为(0,0,0),则b位置 离子的分数坐标为
离子的分数坐标为 离子与
离子与 离子的最近距离为
离子的最近距离为 表示)。
表示)。
您最近一年使用:0次
10 . 铁、镍、铜在医药、催化及材料等领域中都有广泛的应用。回答下列问题:
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为___________ (填轨道表示式)。
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为___________ 。
②不存在的化学键有___________ (填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
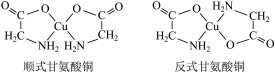
①甘氨酸铜中氮原子的杂化类型为___________ 。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是___________ 。
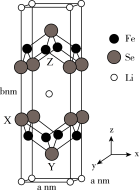
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1, ),Y的坐标为(
),Y的坐标为( ,
, ,
, ),设NA为阿伏加德罗常数的值。坐标为(
),设NA为阿伏加德罗常数的值。坐标为( ,1,
,1, )的是
)的是___________ 原子,Se原子X与Se原子Y之间的距离为___________ nm,该晶体的密度为___________ g·cm-3。
(1)在元素周期表中,某元素和铁、镍既处于同一周期又位于同一族,该元素的基态原子的价电子排布图为
(2)硝普钠(Na2[Fe(CN)5(NO)·2H2O])可用于治疗急性心率衰竭。在硝普钠中:
①第二周期元素第一电离能从大到小的顺序为
②不存在的化学键有
a.离子键 b.金属键 c.配位键 d.极性共价键
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中氮原子的杂化类型为
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是
(4)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1,
 ),Y的坐标为(
),Y的坐标为( ,
, ,
, ),设NA为阿伏加德罗常数的值。坐标为(
),设NA为阿伏加德罗常数的值。坐标为( ,1,
,1, )的是
)的是
您最近一年使用:0次



