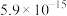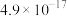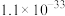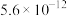1 . 金属钛(Ti)重量轻、强度高、抗腐蚀能力,在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
(1)基态Ti原子的价电子轨道表示式:______ 。
(2) 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
Ⅰ.

Ⅱ.

已知: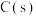 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①
______ 。
②碳氯化反应过程中CO和 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是______ 。 生成CO反应为放热反应
生成CO反应为放热反应
B.升高温度, 平衡转化率减小
平衡转化率减小
C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示 晶胞中
晶胞中 位于
位于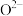 所构成的正八面体的体心,则
所构成的正八面体的体心,则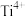 的配位数是6
的配位数是6
③碳氯化法中生成CO比生成 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是______ 。
(3)经光谱分析在碳氯化反应中有光气( )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: 含有
含有______ 个σ键,决速步骤的反应方程式为______ 。
(4)在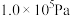 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数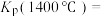
______ Pa。
②图中显示,在200℃平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是______ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。(1)基态Ti原子的价电子轨道表示式:
(2)
 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。Ⅰ.


Ⅱ.


已知:
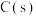 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①

②碳氯化反应过程中CO和
 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是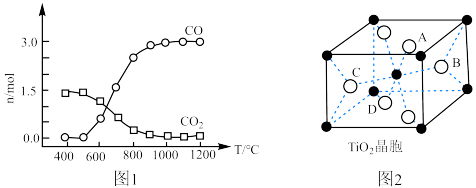
 生成CO反应为放热反应
生成CO反应为放热反应B.升高温度,
 平衡转化率减小
平衡转化率减小C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示
 晶胞中
晶胞中 位于
位于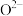 所构成的正八面体的体心,则
所构成的正八面体的体心,则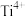 的配位数是6
的配位数是6③碳氯化法中生成CO比生成
 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是(3)经光谱分析在碳氯化反应中有光气(
 )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下:
 含有
含有(4)在
 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
 的平衡常数
的平衡常数
②图中显示,在200℃平衡时
 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
解题方法
2 . 工业上,处理低品位黄铜矿[二硫化亚铁铜( )]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( )。相关流程如下图。
)。相关流程如下图。 1.0~6.0范围内可保持活性。
1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)Cu2+价电子轨道表示式为___________ ,生物堆浸前,需先将矿石进行研磨,目的是___________ 。
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为: 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)结合已知推断:生物堆浸过程中,应控制溶液的 在
在___________ 范围内。
(4)过程Ⅰ中,加入 固体还原堆浸液中的
固体还原堆浸液中的 ,得到溶液X。为判断堆浸液中
,得到溶液X。为判断堆浸液中 是否被还原完全,可取少量溶液X,向其中加入
是否被还原完全,可取少量溶液X,向其中加入___________ ,说明Fe3+已被完全还原。
(5)过程Ⅱ中,用 和稀硫酸处理后,
和稀硫酸处理后,
完全溶解 ,用离子方程式表示 的作用是
的作用是___________ 。
(6)绿矾的纯度可通过 滴定法测定。取
滴定法测定。取 绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的
绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的 溶液滴定,滴定终点的判定方法是
溶液滴定,滴定终点的判定方法是___________ 。至恰好完全反应时,消耗 溶液的体积为
溶液的体积为 。绿矾晶体质量分数的计算式为
。绿矾晶体质量分数的计算式为___________ 。
 )]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( )。相关流程如下图。
)。相关流程如下图。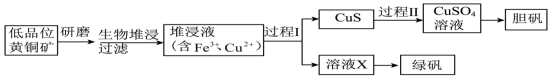
 1.0~6.0范围内可保持活性。
1.0~6.0范围内可保持活性。②金属离子沉淀的pH如下表。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为(3)结合已知推断:生物堆浸过程中,应控制溶液的
 在
在(4)过程Ⅰ中,加入
 固体还原堆浸液中的
固体还原堆浸液中的 ,得到溶液X。为判断堆浸液中
,得到溶液X。为判断堆浸液中 是否被还原完全,可取少量溶液X,向其中加入
是否被还原完全,可取少量溶液X,向其中加入(5)过程Ⅱ中,用
 和稀硫酸处理后,
和稀硫酸处理后,
 的作用是
的作用是(6)绿矾的纯度可通过
 滴定法测定。取
滴定法测定。取 绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的
绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的 溶液滴定,滴定终点的判定方法是
溶液滴定,滴定终点的判定方法是 溶液的体积为
溶液的体积为 。绿矾晶体质量分数的计算式为
。绿矾晶体质量分数的计算式为
您最近一年使用:0次
解题方法
3 . 某合作学习小组将铜片放进氯化铁溶液中,观察到溶液呈无色,产生红褐色固体,铜片表面有白色物质。
Ⅰ.探究红褐色固体成分
(1)过滤得到红褐色固体,所需的仪器有___________ (填标号)。___________ 溶液,溶液变血红色,证明是氢氧化铁。
②产生氢氧化铁的原因可能是___________ (用化学方程式表示)。
Ⅱ.查阅资料:CuCl是白色难溶物
(3)探究产生白色物质的原因。设计实验方案如下:
①由以上实验可知,产生白色物质的条件是___________ 。
②实验2生成白色物质的化学方程式为:___________ 。
③请你从氧化还原反应规律角度分析实验1中未产生白色物质的原因___________ 。
(4)以石墨为电极电解 溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为
溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为___________ 。
(5)基于上述分析,用 溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用
溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用 、KCl、盐酸混合物腐蚀覆铜板,原理为:
、KCl、盐酸混合物腐蚀覆铜板,原理为: 。
。
①基态 的价电子轨道表示式为
的价电子轨道表示式为___________ 。
②KCl的作用是___________ 。
(6)氧化还原反应的应用十分广泛。写出一种氧化剂在生活中的应用___________ 。
Ⅰ.探究红褐色固体成分
(1)过滤得到红褐色固体,所需的仪器有
②产生氢氧化铁的原因可能是
Ⅱ.查阅资料:CuCl是白色难溶物
(3)探究产生白色物质的原因。设计实验方案如下:
| 实验 | 铜粉/g |  /g /g | 蒸馏水/mL | 实验现象 |
| 1 | 0.1 | 1.8 | 2 | 棕黄色溶液变为墨绿色 |
| 2 | 0.5 | 1.8 | 2 | 棕黄色溶液变为白色浊液 |
②实验2生成白色物质的化学方程式为:
③请你从氧化还原反应规律角度分析实验1中未产生白色物质的原因
(4)以石墨为电极电解
 溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为
溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为(5)基于上述分析,用
 溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用
溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用 、KCl、盐酸混合物腐蚀覆铜板,原理为:
、KCl、盐酸混合物腐蚀覆铜板,原理为: 。
。①基态
 的价电子轨道表示式为
的价电子轨道表示式为②KCl的作用是
(6)氧化还原反应的应用十分广泛。写出一种氧化剂在生活中的应用
您最近一年使用:0次
解题方法
4 .  是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。
(1)配合物广泛存在于自然界,其中 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。
①基态 的3d电子轨道表示式为
的3d电子轨道表示式为_______ 。
② 的配位原子是
的配位原子是_______ ,氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是_______ 。
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.

Ⅱ.

①反应

_______ 。
②不同温度下氨催化氧化的平衡常数如下(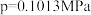 );
);
下列说法正确的是_______ 。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:
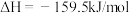
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
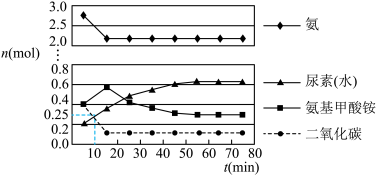
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成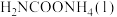 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为_______ 。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是_______ ,第一步反应的平衡常数
_______ (列出算式即可)。
 是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。(1)配合物广泛存在于自然界,其中
 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。①基态
 的3d电子轨道表示式为
的3d电子轨道表示式为②
 的配位原子是
的配位原子是(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.


Ⅱ.


①反应


②不同温度下氨催化氧化的平衡常数如下(
 );
);| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
反应Ⅰ( ) ) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
反应Ⅱ( ) ) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.如果对反应不加控制,氨和氧气反应的最终产物主要是

B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:

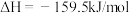
第二步:在体积为5 L的密闭容器中加入1 mol
 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成
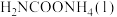 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是

您最近一年使用:0次
解题方法
5 . 化学符号诠释着物质组成的规律。下列化学符号表示正确的是
| A.C2H4的结构简式为CH2CH2 |
B.CO2的电子式为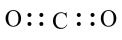 |
C.H2O的球棍模型为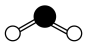 |
D.基态Fe3+价层电子轨道表示式为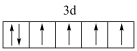 |
您最近一年使用:0次
6 . 用“氧化-萃取法”可从卤水中提取碘,其方法为向酸化的卤水中加入 溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
(ⅰ)

(ⅱ)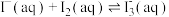
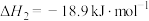
(ⅲ)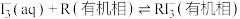
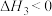
(1)根据盖斯定律,反应

________ 。
(2)基态碘原子价层电子的轨道表示式为________ 。
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率
[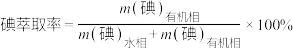 ]曲线如图所示:
]曲线如图所示:_______________ (忽略萃取剂的挥发、 的挥发及
的挥发及 分解产生的影响)。当萃取温度超过320 K时,
分解产生的影响)。当萃取温度超过320 K时, 的分解导致碘萃取率明显下降。
的分解导致碘萃取率明显下降。
②下列说法不正确的是________ (填标号)。
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释, 变小 D.增大
变小 D.增大 的浓度,反应(ⅰ)的速率增大
的浓度,反应(ⅰ)的速率增大
(4)未加萃取剂时,固定总碘浓度为 ,平衡时溶液中的
,平衡时溶液中的 、
、 、
、 分布系数
分布系数 与溶液中初始
与溶液中初始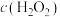 关系如图所示。[总碘浓度
关系如图所示。[总碘浓度 各组分折合为
各组分折合为 后的浓度之和,
后的浓度之和, ,如
,如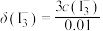 ]
] 、
、 、
、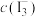 分别为
分别为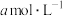 、
、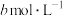 、
、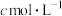 ,则
,则 、
、 、
、 之间的关系式为
之间的关系式为________ 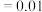 。
。
②计算反应 的平衡常数
的平衡常数
________ (结果保留3位有效数字)。
(5)测定卤水中的 方法:取
方法:取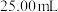 卤水于锥形瓶中,加适量氧化剂恰好将
卤水于锥形瓶中,加适量氧化剂恰好将 全部氧化为
全部氧化为 ;加
;加 溶液酸化后,再加入适量
溶液酸化后,再加入适量 溶液,密闭静置后,用
溶液,密闭静置后,用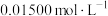
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗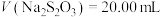 ,则卤水中
,则卤水中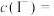
________  。(已知:
。(已知: )
)
 溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:(ⅰ)


(ⅱ)
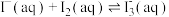
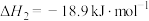
(ⅲ)
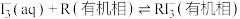
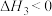
(1)根据盖斯定律,反应


(2)基态碘原子价层电子的轨道表示式为
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率
[
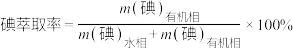 ]曲线如图所示:
]曲线如图所示: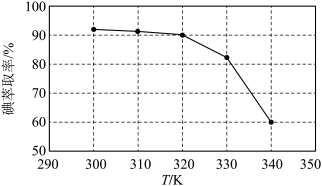
 的挥发及
的挥发及 分解产生的影响)。当萃取温度超过320 K时,
分解产生的影响)。当萃取温度超过320 K时, 的分解导致碘萃取率明显下降。
的分解导致碘萃取率明显下降。②下列说法不正确的是
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释,
 变小 D.增大
变小 D.增大 的浓度,反应(ⅰ)的速率增大
的浓度,反应(ⅰ)的速率增大(4)未加萃取剂时,固定总碘浓度为
 ,平衡时溶液中的
,平衡时溶液中的 、
、 、
、 分布系数
分布系数 与溶液中初始
与溶液中初始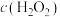 关系如图所示。[总碘浓度
关系如图所示。[总碘浓度 各组分折合为
各组分折合为 后的浓度之和,
后的浓度之和, ,如
,如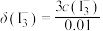 ]
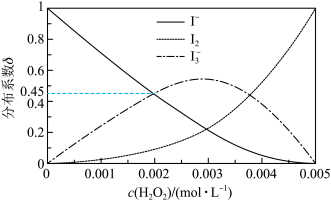
]
 、
、 、
、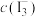 分别为
分别为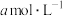 、
、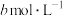 、
、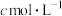 ,则
,则 、
、 、
、 之间的关系式为
之间的关系式为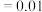 。
。②计算反应
 的平衡常数
的平衡常数
(5)测定卤水中的
 方法:取
方法:取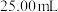 卤水于锥形瓶中,加适量氧化剂恰好将
卤水于锥形瓶中,加适量氧化剂恰好将 全部氧化为
全部氧化为 ;加
;加 溶液酸化后,再加入适量
溶液酸化后,再加入适量 溶液,密闭静置后,用
溶液,密闭静置后,用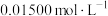
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗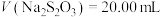 ,则卤水中
,则卤水中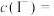
 。(已知:
。(已知: )
)
您最近一年使用:0次
7 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al等)制备Co2O3和Li2CO3。工艺流程如下: 如下表:
如下表:
②常温时, 的溶度积
的溶度积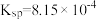 ,该数值随温度升高而减小。
,该数值随温度升高而减小。
(1)LiCoO2中Co元素的化合价为______ ;基态Co原子的价层电子轨道表示式为______ 。
(2)“酸浸”时发生反应: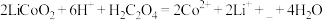 。
。
①补充完整上述离子方程式______ ;
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是______ 。
(3)已知滤渣2中含有 ,则常温下滤液2中
,则常温下滤液2中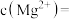
______ mol/L。
(4)滤液3中含金属元素的离子主要是 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为______ 。
(5)沉锂操作过程中的存在反应: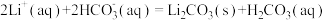 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是______ 。
(6)由 进一步制得的
进一步制得的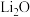 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为______ ;
②设阿伏加德罗常数的值为 。晶胞
。晶胞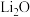 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为______ pm。

 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
 的溶度积
的溶度积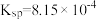 ,该数值随温度升高而减小。
,该数值随温度升高而减小。(1)LiCoO2中Co元素的化合价为
(2)“酸浸”时发生反应:
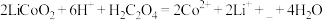 。
。①补充完整上述离子方程式
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是
(3)已知滤渣2中含有
 ,则常温下滤液2中
,则常温下滤液2中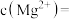
(4)滤液3中含金属元素的离子主要是
 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为(5)沉锂操作过程中的存在反应:
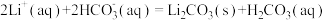 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。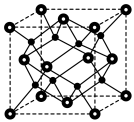
 在晶胞中的位置为
在晶胞中的位置为②设阿伏加德罗常数的值为
 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为
您最近一年使用:0次
8 . 钒和铬都是重要的战略金属,利用钒、铬废渣(主要成分为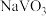 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。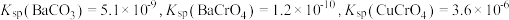 。
。
回答下列问题:
(1)基态铬原子价电子轨道表示式为_______ 。
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有_______ (任写一点)。
(3)“沉钒”的含钒产物为钒酸钙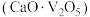 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是_______ 。
(4)“沉铬”时,铬转化为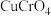 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为_______ 。
(5)向“沉钒后液”中加入足量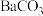 ,可将其中的铬转化为
,可将其中的铬转化为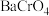 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为_______ (保留三位有效数字) 。
。
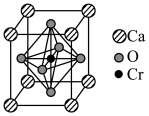
(6)复合材料氧铬酸钙的立方晶胞如下图所示。_______ 。
②已知该晶体的密度为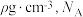 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与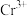 之间的最短距离为
之间的最短距离为_______ 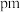 (列出计算式即可)。
(列出计算式即可)。
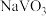 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。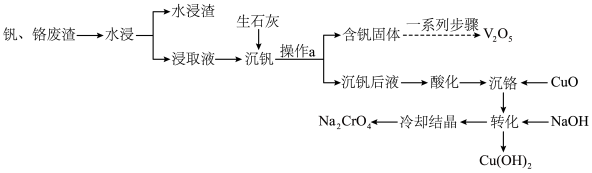
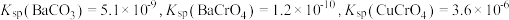 。
。回答下列问题:
(1)基态铬原子价电子轨道表示式为
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有
(3)“沉钒”的含钒产物为钒酸钙
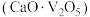 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是(4)“沉铬”时,铬转化为
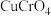 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为(5)向“沉钒后液”中加入足量
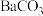 ,可将其中的铬转化为
,可将其中的铬转化为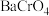 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为 。
。(6)复合材料氧铬酸钙的立方晶胞如下图所示。
②已知该晶体的密度为
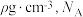 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与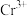 之间的最短距离为
之间的最短距离为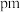 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-02-27更新
|
540次组卷
|
3卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
广东省湛江市2024届高三下学期第二次模拟测试化学试题贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
解题方法
9 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液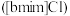 可以与
可以与 混合形成离子液体;
混合形成离子液体;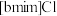 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是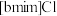 与
与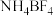 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:

(1)请画出基态Ga原子的价电子排布图_____ ;同周期元素中基态原子未成对电子数与硼(B)原子相同的有_____ (填元素符号)。
(2)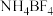 中N原子的杂化方式为
中N原子的杂化方式为_____ ,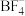 的空间构型为
的空间构型为_____ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为_____ 。
(3)已知分子中的大 键可以用
键可以用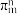 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为_____ 。
(4) 熔点为
熔点为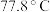 ,则
,则 的晶体类型为
的晶体类型为_____ , 和
和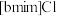 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: ,请画出
,请画出 的结构式
的结构式_____ 。
(5)某种 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
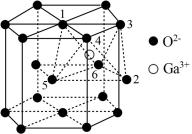
①该晶胞中O2−的配位数为_____ 。
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为_____ g·cm−3(用含 和NA的代数式表示)。
和NA的代数式表示)。
 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与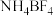 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:
(1)请画出基态Ga原子的价电子排布图
(2)
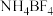 中N原子的杂化方式为
中N原子的杂化方式为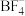 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用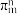 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为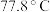 ,则
,则 的晶体类型为
的晶体类型为 和
和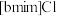 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: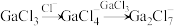 ,请画出
,请画出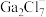 的结构式
的结构式(5)某种
 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
①该晶胞中O2−的配位数为
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 和NA的代数式表示)。
和NA的代数式表示)。
您最近一年使用:0次
解题方法
10 . 化合物T是一种用于合成药物的重要试剂,其结构简式如图所示。已知X、Y、Z、M、N为原子序数依次增大的前四周期主族元素,Z、M位于同一主族,X、Y、N的最外层电子数之和等于Z的最外层电子数。下列有关说法不正确的是


A.Y的基态原子的电子轨道表示式: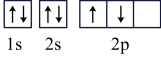 |
| B.简单离子半径:M>N |
| C.简单气态氢化物稳定性:Z>M |
| D.化合物YM2分子中含有σ键和π键 |
您最近一年使用:0次