名校
解题方法
1 . 下列化学用语或图示表达正确 的是
A.溴的简化电子排布式: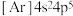 |
B.基态24Cr原子的价层电子轨道表示式为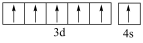 |
C.1-丁醇的键线式: |
D.NH3分子的VSEPR模型为 |
您最近一年使用:0次
2 . 1934年,约里奥—居里夫妇在核反应中用α粒子(氦核 )轰击金属铝,得到磷,开创了人工放射性核素的先河,其核反应为
)轰击金属铝,得到磷,开创了人工放射性核素的先河,其核反应为 。下列化学用语正确的是
。下列化学用语正确的是
 )轰击金属铝,得到磷,开创了人工放射性核素的先河,其核反应为
)轰击金属铝,得到磷,开创了人工放射性核素的先河,其核反应为 。下列化学用语正确的是
。下列化学用语正确的是A.基态A1原子的价层电子轨道表示式为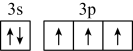 |
| B.He没有共价键,不是非极性分子 |
C.明矾的化学式为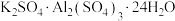 |
| D.基态P原子中p能级的轨道总数为3 |
您最近一年使用:0次
解题方法
3 . 工业上,处理低品位黄铜矿[二硫化亚铁铜( )]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( )。相关流程如下图。
)。相关流程如下图。 1.0~6.0范围内可保持活性。
1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)Cu2+价电子轨道表示式为___________ ,生物堆浸前,需先将矿石进行研磨,目的是___________ 。
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为: 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)结合已知推断:生物堆浸过程中,应控制溶液的 在
在___________ 范围内。
(4)过程Ⅰ中,加入 固体还原堆浸液中的
固体还原堆浸液中的 ,得到溶液X。为判断堆浸液中
,得到溶液X。为判断堆浸液中 是否被还原完全,可取少量溶液X,向其中加入
是否被还原完全,可取少量溶液X,向其中加入___________ ,说明Fe3+已被完全还原。
(5)过程Ⅱ中,用 和稀硫酸处理后,
和稀硫酸处理后,
完全溶解 ,用离子方程式表示 的作用是
的作用是___________ 。
(6)绿矾的纯度可通过 滴定法测定。取
滴定法测定。取 绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的
绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的 溶液滴定,滴定终点的判定方法是
溶液滴定,滴定终点的判定方法是___________ 。至恰好完全反应时,消耗 溶液的体积为
溶液的体积为 。绿矾晶体质量分数的计算式为
。绿矾晶体质量分数的计算式为___________ 。
 )]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( )。相关流程如下图。
)。相关流程如下图。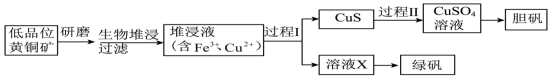
 1.0~6.0范围内可保持活性。
1.0~6.0范围内可保持活性。②金属离子沉淀的pH如下表。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为(3)结合已知推断:生物堆浸过程中,应控制溶液的
 在
在(4)过程Ⅰ中,加入
 固体还原堆浸液中的
固体还原堆浸液中的 ,得到溶液X。为判断堆浸液中
,得到溶液X。为判断堆浸液中 是否被还原完全,可取少量溶液X,向其中加入
是否被还原完全,可取少量溶液X,向其中加入(5)过程Ⅱ中,用
 和稀硫酸处理后,
和稀硫酸处理后,
 的作用是
的作用是(6)绿矾的纯度可通过
 滴定法测定。取
滴定法测定。取 绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的
绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的 溶液滴定,滴定终点的判定方法是
溶液滴定,滴定终点的判定方法是 溶液的体积为
溶液的体积为 。绿矾晶体质量分数的计算式为
。绿矾晶体质量分数的计算式为
您最近一年使用:0次
解题方法
4 .  是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。
(1)配合物广泛存在于自然界,其中 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。
①基态 的3d电子轨道表示式为
的3d电子轨道表示式为_______ 。
② 的配位原子是
的配位原子是_______ ,氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是_______ 。
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.

Ⅱ.

①反应

_______ 。
②不同温度下氨催化氧化的平衡常数如下(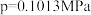 );
);
下列说法正确的是_______ 。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
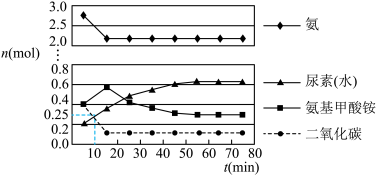
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成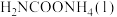 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为_______ 。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是_______ ,第一步反应的平衡常数
_______ (列出算式即可)。
 是重要的化工原料,在生产和生活中都发挥着重要作用。
是重要的化工原料,在生产和生活中都发挥着重要作用。(1)配合物广泛存在于自然界,其中
 能与
能与 形成深蓝色
形成深蓝色 溶液。
溶液。①基态
 的3d电子轨道表示式为
的3d电子轨道表示式为②
 的配位原子是
的配位原子是(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.


Ⅱ.


①反应


②不同温度下氨催化氧化的平衡常数如下(
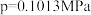 );
);| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
反应Ⅰ( ) ) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
反应Ⅱ( ) ) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.如果对反应不加控制,氨和氧气反应的最终产物主要是

B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:

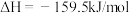
第二步:在体积为5 L的密闭容器中加入1 mol
 和4 mol
和4 mol  ,在一定条件下反应进行到10 min时,测得
,在一定条件下反应进行到10 min时,测得 和尿素的物质的量均为0.25 mol,15 min后,测得
和尿素的物质的量均为0.25 mol,15 min后,测得 的物质的量为0.1 mol,如图所示。
的物质的量为0.1 mol,如图所示。
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成
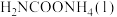 (氨基甲酸铵)的平均反应速率为
(氨基甲酸铵)的平均反应速率为②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是

您最近一年使用:0次
解题方法
5 . 化学符号诠释着物质组成的规律。下列化学符号表示正确的是
| A.C2H4的结构简式为CH2CH2 |
B.CO2的电子式为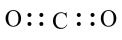 |
C.H2O的球棍模型为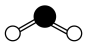 |
D.基态Fe3+价层电子轨道表示式为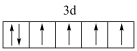 |
您最近一年使用:0次
6 . 用“氧化-萃取法”可从卤水中提取碘,其方法为向酸化的卤水中加入 溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
(ⅰ)

(ⅱ)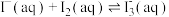
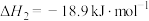
(ⅲ)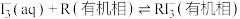
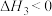
(1)根据盖斯定律,反应

________ 。
(2)基态碘原子价层电子的轨道表示式为________ 。
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率
[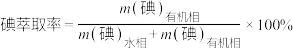 ]曲线如图所示:
]曲线如图所示:_______________ (忽略萃取剂的挥发、 的挥发及
的挥发及 分解产生的影响)。当萃取温度超过320 K时,
分解产生的影响)。当萃取温度超过320 K时, 的分解导致碘萃取率明显下降。
的分解导致碘萃取率明显下降。
②下列说法不正确的是________ (填标号)。
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释, 变小 D.增大
变小 D.增大 的浓度,反应(ⅰ)的速率增大
的浓度,反应(ⅰ)的速率增大
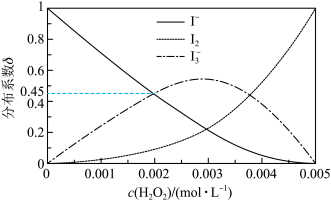
(4)未加萃取剂时,固定总碘浓度为 ,平衡时溶液中的
,平衡时溶液中的 、
、 、
、 分布系数
分布系数 与溶液中初始
与溶液中初始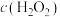 关系如图所示。[总碘浓度
关系如图所示。[总碘浓度 各组分折合为
各组分折合为 后的浓度之和,
后的浓度之和, ,如
,如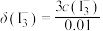 ]
] 、
、 、
、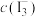 分别为
分别为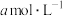 、
、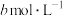 、
、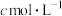 ,则
,则 、
、 、
、 之间的关系式为
之间的关系式为________ 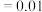 。
。
②计算反应 的平衡常数
的平衡常数
________ (结果保留3位有效数字)。
(5)测定卤水中的 方法:取
方法:取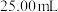 卤水于锥形瓶中,加适量氧化剂恰好将
卤水于锥形瓶中,加适量氧化剂恰好将 全部氧化为
全部氧化为 ;加
;加 溶液酸化后,再加入适量
溶液酸化后,再加入适量 溶液,密闭静置后,用
溶液,密闭静置后,用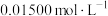
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗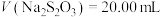 ,则卤水中
,则卤水中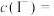
________  。(已知:
。(已知: )
)
 溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:(ⅰ)


(ⅱ)
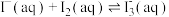
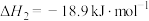
(ⅲ)
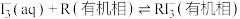
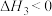
(1)根据盖斯定律,反应


(2)基态碘原子价层电子的轨道表示式为
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率
[
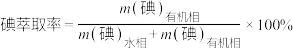 ]曲线如图所示:
]曲线如图所示: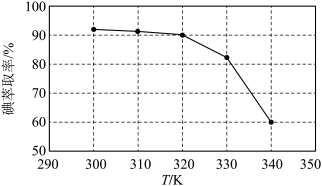
 的挥发及
的挥发及 分解产生的影响)。当萃取温度超过320 K时,
分解产生的影响)。当萃取温度超过320 K时, 的分解导致碘萃取率明显下降。
的分解导致碘萃取率明显下降。②下列说法不正确的是
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释,
 变小 D.增大
变小 D.增大 的浓度,反应(ⅰ)的速率增大
的浓度,反应(ⅰ)的速率增大(4)未加萃取剂时,固定总碘浓度为
 ,平衡时溶液中的
,平衡时溶液中的 、
、 、
、 分布系数
分布系数 与溶液中初始
与溶液中初始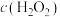 关系如图所示。[总碘浓度
关系如图所示。[总碘浓度 各组分折合为
各组分折合为 后的浓度之和,
后的浓度之和, ,如
,如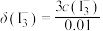 ]
]
 、
、 、
、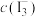 分别为
分别为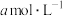 、
、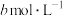 、
、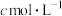 ,则
,则 、
、 、
、 之间的关系式为
之间的关系式为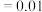 。
。②计算反应
 的平衡常数
的平衡常数
(5)测定卤水中的
 方法:取
方法:取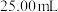 卤水于锥形瓶中,加适量氧化剂恰好将
卤水于锥形瓶中,加适量氧化剂恰好将 全部氧化为
全部氧化为 ;加
;加 溶液酸化后,再加入适量
溶液酸化后,再加入适量 溶液,密闭静置后,用
溶液,密闭静置后,用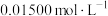
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗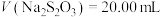 ,则卤水中
,则卤水中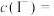
 。(已知:
。(已知: )
)
您最近一年使用:0次
解题方法
7 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液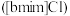 可以与
可以与 混合形成离子液体;
混合形成离子液体;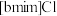 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是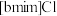 与
与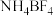 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:

(1)请画出基态Ga原子的价电子排布图_____ ;同周期元素中基态原子未成对电子数与硼(B)原子相同的有_____ (填元素符号)。
(2)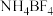 中N原子的杂化方式为
中N原子的杂化方式为_____ ,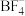 的空间构型为
的空间构型为_____ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为_____ 。
(3)已知分子中的大 键可以用
键可以用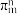 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为_____ 。
(4) 熔点为
熔点为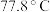 ,则
,则 的晶体类型为
的晶体类型为_____ , 和
和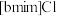 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: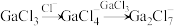 ,请画出
,请画出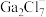 的结构式
的结构式_____ 。
(5)某种 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
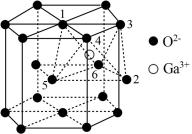
①该晶胞中O2−的配位数为_____ 。
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为_____ g·cm−3(用含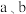 和NA的代数式表示)。
和NA的代数式表示)。
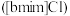 可以与
可以与 混合形成离子液体;
混合形成离子液体;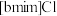 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是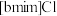 与
与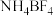 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:
(1)请画出基态Ga原子的价电子排布图
(2)
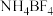 中N原子的杂化方式为
中N原子的杂化方式为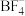 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用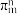 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为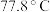 ,则
,则 的晶体类型为
的晶体类型为 和
和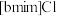 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: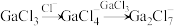 ,请画出
,请画出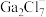 的结构式
的结构式(5)某种
 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
①该晶胞中O2−的配位数为
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 和NA的代数式表示)。
和NA的代数式表示)。
您最近一年使用:0次
解题方法
8 . 化合物T是一种用于合成药物的重要试剂,其结构简式如图所示。已知X、Y、Z、M、N为原子序数依次增大的前四周期主族元素,Z、M位于同一主族,X、Y、N的最外层电子数之和等于Z的最外层电子数。下列有关说法不正确的是


A.Y的基态原子的电子轨道表示式: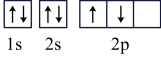 |
| B.简单离子半径:M>N |
| C.简单气态氢化物稳定性:Z>M |
| D.化合物YM2分子中含有σ键和π键 |
您最近一年使用:0次
名校
解题方法
9 . 下列物质的化学用语正确的是
A.H2O2的电子式: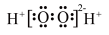 |
B.CO2的结构式: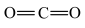 |
C.中子数为18的 原子: 原子: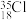 |
D.基态碳原子的最外层电子排布图: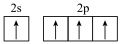 |
您最近一年使用:0次
2023-05-06更新
|
624次组卷
|
3卷引用:广东省惠州市2024届高三第一次调研考试化学试题
解题方法
10 . 聚四氟乙烯被称为“塑料王”,其合成路线如图(已知Sb为第五周期第VA族元素)。
CHCl3 CHClF2
CHClF2 CF2=CF2
CF2=CF2
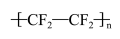
下列说法正确的是
CHCl3
 CHClF2
CHClF2 CF2=CF2
CF2=CF2
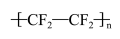
下列说法正确的是
A.CHCl3的电子式为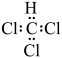 |
B.四氟乙烯分子的球棍模型为 |
| C.CHClF2不存在同分异构体 |
| D.基态Sb原子的价层电子的轨道表示式为5s25p3 |
您最近一年使用:0次



