1 . 金属钛(Ti)重量轻、强度高、抗腐蚀能力,在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
(1)基态Ti原子的价电子轨道表示式:______ 。
(2) 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
Ⅰ.

Ⅱ.

已知: 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①
______ 。
②碳氯化反应过程中CO和 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是______ 。 生成CO反应为放热反应
生成CO反应为放热反应
B.升高温度, 平衡转化率减小
平衡转化率减小
C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示 晶胞中
晶胞中 位于
位于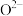 所构成的正八面体的体心,则
所构成的正八面体的体心,则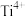 的配位数是6
的配位数是6
③碳氯化法中生成CO比生成 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是______ 。
(3)经光谱分析在碳氯化反应中有光气( )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: 含有
含有______ 个σ键,决速步骤的反应方程式为______ 。
(4)在 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数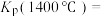
______ Pa。
②图中显示,在200℃平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是______ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。(1)基态Ti原子的价电子轨道表示式:
(2)
 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。Ⅰ.


Ⅱ.


已知:
 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①

②碳氯化反应过程中CO和
 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是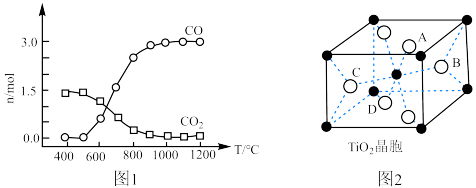
 生成CO反应为放热反应
生成CO反应为放热反应B.升高温度,
 平衡转化率减小
平衡转化率减小C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示
 晶胞中
晶胞中 位于
位于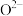 所构成的正八面体的体心,则
所构成的正八面体的体心,则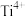 的配位数是6
的配位数是6③碳氯化法中生成CO比生成
 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是(3)经光谱分析在碳氯化反应中有光气(
 )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: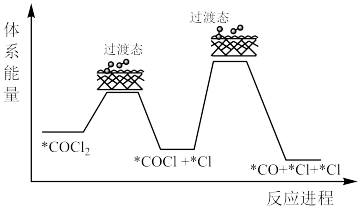
 含有
含有(4)在
 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
 的平衡常数
的平衡常数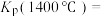
②图中显示,在200℃平衡时
 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
2024-05-20更新
|
588次组卷
|
2卷引用:广东省汕头市2024届高三二模考试化学试
名校
解题方法
2 . 镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为___________ 。
(2)含有4个水分子的醋酸镍[ ]在电镀中有广泛应用,其中
]在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为___________ ,若该构型为八面体,则中心 原子的配位数为
原子的配位数为___________ 。
(3) 、
、 的晶体结构类型均与氯化钠的相同,已知熔点
的晶体结构类型均与氯化钠的相同,已知熔点 ,则离子半径
,则离子半径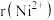
___________ 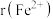 (填“<”或“>”);天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
(填“<”或“>”);天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为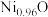 ,其中
,其中 元素只有
元素只有 和
和 两种价态,两种价态的镍离子数目之比为
两种价态,两种价态的镍离子数目之比为___________ 。
(4)四羰基镍[ ]是由路德维希·蒙德所发现。室温下,它是一种具挥发性的液体,其熔沸点低的原因是
]是由路德维希·蒙德所发现。室温下,它是一种具挥发性的液体,其熔沸点低的原因是___________ ; 分子内
分子内 键与
键与 键个数之比为
键个数之比为___________ 。
(5)金属镍与镧( )形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。若阿伏加德罗常数的值为 ,晶胞边长为
,晶胞边长为 ,则该晶胞的密度为
,则该晶胞的密度为___________  。
。

(1)基态
 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为(2)含有4个水分子的醋酸镍[
 ]在电镀中有广泛应用,其中
]在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为 原子的配位数为
原子的配位数为(3)
 、
、 的晶体结构类型均与氯化钠的相同,已知熔点
的晶体结构类型均与氯化钠的相同,已知熔点 ,则离子半径
,则离子半径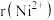
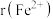 (填“<”或“>”);天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
(填“<”或“>”);天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为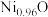 ,其中
,其中 元素只有
元素只有 和
和 两种价态,两种价态的镍离子数目之比为
两种价态,两种价态的镍离子数目之比为(4)四羰基镍[
 ]是由路德维希·蒙德所发现。室温下,它是一种具挥发性的液体,其熔沸点低的原因是
]是由路德维希·蒙德所发现。室温下,它是一种具挥发性的液体,其熔沸点低的原因是 分子内
分子内 键与
键与 键个数之比为
键个数之比为(5)金属镍与镧(
 )形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。若阿伏加德罗常数的值为 ,晶胞边长为
,晶胞边长为 ,则该晶胞的密度为
,则该晶胞的密度为 。
。
您最近一年使用:0次
2022-01-22更新
|
669次组卷
|
5卷引用:广东省茂名市2022届高三第一次综合测试(一模)化学试题
广东省茂名市2022届高三第一次综合测试(一模)化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(广东专用)(已下线)押广东卷化学第20题 物质结构与性质综合题-备战2022年高考化学临考题号押题(广东卷)(已下线)专题19 物质结构与性质综合题-备战2023年高考化学母题题源解密(广东卷)安徽师范大学附属中学2022届高三下学期第十六次综合测试理综化学试题
名校
解题方法
3 . 氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过_____ 方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为______ 。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______ ,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______ 、______
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在______ (填序号):
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJ•mol-1,S-F的键能为______ kJ•mol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g•cm-3。
①CuF比CuCl熔点高的原因是______ ;
②已知NA为阿伏伽德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___ nm (列出计算式)。

(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过
(2)基态铜原子价电子排布的轨道式为
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJ•mol-1,S-F的键能为
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g•cm-3。
①CuF比CuCl熔点高的原因是
②已知NA为阿伏伽德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=

您最近一年使用:0次
2019-04-28更新
|
504次组卷
|
3卷引用:【市级联考】广东省肇庆市2019届高中毕业班第三次统一检测理综化学试题
4 . 铜及其化合物在科研和生产中具有广泛用途。回答下列问题:
(l)基态Cu原子的价电子排布图是____ 。
(2)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是____ 。
(3)铜晶体中Cu原子的堆积方式如图所示,其堆积方式为____ ,配位数为____ .

(4)NH3中N原子的杂化方式是____ ;C、N、O元素的第一电离能由大到小的顺序是____ (用元素符号表示);SO42-的空间构型是____ ,与该阴离子互为等电子体的五核微粒有____ (任写1种)。
(5)由铜、钡、钙及铊的氧化物可以制得高温超导体,CaO的熔点比BaO的熔点高,其原因是____ 。

(6)金铜合金的晶胞如图所示。金铜合金具有储氢功能,储氢后Au原子位于顶点,Cu原子位于面心,H原子填充在由1个Au原子和距Au原子最近的3个Cu原子构成的四面体空隙中,若Cu原子与Au原子的最短距离为a nm,阿伏伽德罗常数的值为NA,则该晶体储氢后密度为___________ g.cm-3(列出计算式)。
(l)基态Cu原子的价电子排布图是
(2)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是
(3)铜晶体中Cu原子的堆积方式如图所示,其堆积方式为

(4)NH3中N原子的杂化方式是
(5)由铜、钡、钙及铊的氧化物可以制得高温超导体,CaO的熔点比BaO的熔点高,其原因是

(6)金铜合金的晶胞如图所示。金铜合金具有储氢功能,储氢后Au原子位于顶点,Cu原子位于面心,H原子填充在由1个Au原子和距Au原子最近的3个Cu原子构成的四面体空隙中,若Cu原子与Au原子的最短距离为a nm,阿伏伽德罗常数的值为NA,则该晶体储氢后密度为
您最近一年使用:0次
解题方法
5 . 钠的化合物用途广泛,回答下列问题:
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为___________ ,基态S原子电子占据最高能级的电子云轮廓图为___________ ,其中Na2S4中存在的化学键有:___________ 。
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是___________ 。
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是___________ ,空间构型是______________________ 。
(4)下表列出了钠的卤化物的熔点:
①NaF的熔点比NaI的熔点高的原因是_________________________________ ;
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是___________ 。
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
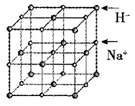
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为___________ pm;NaH的理论密度是___________ g·cm-3(保留三位有效数字)。[H—1、Na—23]
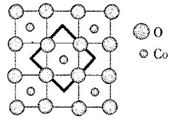
(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶胞,则x=___________ 。
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是
(4)下表列出了钠的卤化物的熔点:
| 化学式 | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为

(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶胞,则x=

您最近一年使用:0次



