名校
解题方法
1 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(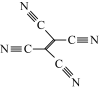 )。
)。
①CH3CN中碳原子的杂化方式是____ 和_____ 。
②TCNE中第一电离能较大的是___ (填元素符号),分子中所有原子____ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为___ (列出计算式)g·cm-3。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为
您最近一年使用:0次
2020-04-06更新
|
624次组卷
|
4卷引用:01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题江西省九江市十校2020届高三下学期模拟考试理综化学试题
名校
解题方法
2 . 碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布式______________ ,核外有_________ 种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
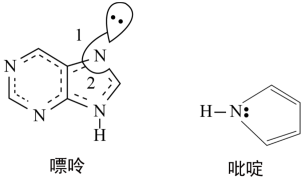
①嘌呤中所有元素的电负性由大到小的顺序__________________ 。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因__________________ 。
③吡啶结构中N原子的杂化方式__________________ 。
④分子中的大π键可用符号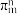 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为
表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为__________ 。
(3)碳元素能形成CO、CO2、H2CO3等多种无机化合物。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有__________ 个紧邻的分子。
②在CO转化成CO2的反应过程中,下列说法正确的是__________ 。
A.分子中孤电子对数不变 B.分子的极性发生变化
C.原子间成键方式发生改变 D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因_________ 。
(4)2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为__________ g/cm3。(写出表达式即可)

(1)碳原子的价电子排布式
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③吡啶结构中N原子的杂化方式
④分子中的大π键可用符号
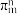 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为
表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为(3)碳元素能形成CO、CO2、H2CO3等多种无机化合物。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有
②在CO转化成CO2的反应过程中,下列说法正确的是
A.分子中孤电子对数不变 B.分子的极性发生变化
C.原子间成键方式发生改变 D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因
(4)2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为

您最近一年使用:0次
2018-04-14更新
|
365次组卷
|
2卷引用:江西省抚州市资溪县第一中学2022-2023学年高二下学期5月期中考试化学试题



