碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布式______________ ,核外有_________ 种不同运动状态的电子。
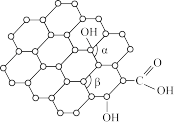
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
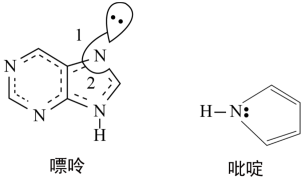
①嘌呤中所有元素的电负性由大到小的顺序__________________ 。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因__________________ 。
③吡啶结构中N原子的杂化方式__________________ 。
④分子中的大π键可用符号 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为
表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为__________ 。
(3)碳元素能形成CO、CO2、H2CO3等多种无机化合物。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有__________ 个紧邻的分子。
②在CO转化成CO2的反应过程中,下列说法正确的是__________ 。
A.分子中孤电子对数不变 B.分子的极性发生变化
C.原子间成键方式发生改变 D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因_________ 。
(4)2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为__________ g/cm3。(写出表达式即可)

(1)碳原子的价电子排布式
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③吡啶结构中N原子的杂化方式
④分子中的大π键可用符号
 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为
表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为(3)碳元素能形成CO、CO2、H2CO3等多种无机化合物。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有
②在CO转化成CO2的反应过程中,下列说法正确的是
A.分子中孤电子对数不变 B.分子的极性发生变化
C.原子间成键方式发生改变 D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因
(4)2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为

更新时间:2018-04-14 12:58:05
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】按照要求回答下列问题。
(1)高温下,Cu2O比CuO稳定,原因是___________ 。
(2)过渡元素的原子或者离子很容易形成配合物,Fe(CO)5就是其一,它相当活泼,在一定条件下可生成Fe(CO)3(CH3OH)。1.5 mol Fe(CO)5中所含配位键的个数为___________ ,Fe(CO)3(CH3OH)的配位原子为___________ 。(填元素符号)
(3)第四周期第一电离能数值介于Ga和As之间的主族元素有:___________ 。(填名称)
(4)金属钛重量轻、强度高,航空发动机用的高温钛合金和机体用的结构钛合金是钛合金的主要发展方向。钛原子的外围电子排布图为___________ 。已知金属Be的堆积方式与金属钛相同,则堆积方式为___________ ,Be与NaOH溶液反应的离子方程式为___________ 。
(5)Sr晶体堆积方式与Cu相似,设Sr的原子直径为a,则Sr晶体的空间利用率为___________ 。(请用含有a的表达式表示,不要化简)
(1)高温下,Cu2O比CuO稳定,原因是
(2)过渡元素的原子或者离子很容易形成配合物,Fe(CO)5就是其一,它相当活泼,在一定条件下可生成Fe(CO)3(CH3OH)。1.5 mol Fe(CO)5中所含配位键的个数为
(3)第四周期第一电离能数值介于Ga和As之间的主族元素有:
(4)金属钛重量轻、强度高,航空发动机用的高温钛合金和机体用的结构钛合金是钛合金的主要发展方向。钛原子的外围电子排布图为
(5)Sr晶体堆积方式与Cu相似,设Sr的原子直径为a,则Sr晶体的空间利用率为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】深入认识物质的结构有助于进一步开发物质的用途。
(1)钾或钾的化合物焰色反应为紫色。下列对其原理的分析中,正确的是___________ (填字母)。
A.电子从基态跃迁到较高的激发态 B.电子从较高的激发态跃迁到基态
C.焰色反应的光谱属于吸收光谱 D.焰色反应的光谱属于发射光谱
(2)镓(Ga)的价层电子排布式为___________ 。与Ga元素同周期,且基态原子有2个未成对电子的过渡元素是___________ (填元素符号)。
(3) 的空间构型为
的空间构型为___________ ,中心原子S的杂化方式为___________ 。[Ag(S2O3)2]3-中不存在的化学键是___________ (填字母序号)
A.离子键 B.极性键 C.非极性键 D.配位键
(4)近年来,人们发现了双氢键,双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。下列不可能形成双氢键的是___________ 。
A.Be—H……H—O B.O—H……H—N
C.Si—H……H—Al D.B—H……H—N
(5)从结构的角度解释:MgCO3热分解温度低于CaCO3热分解温度的原因是___________ 。
(6)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa(镧)的合金可吸附H2的质量为___________ g。
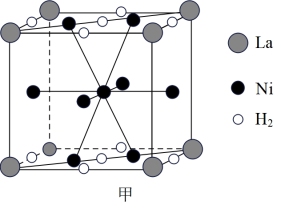
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg处于乙图八个小立方体的体心。若晶体的密度为ρg/cm3,NA是阿伏加德罗常数,则Mg原子与Ni原子的最短距离为___________ cm。(用含ρ、NA的代数式表示)
(1)钾或钾的化合物焰色反应为紫色。下列对其原理的分析中,正确的是
A.电子从基态跃迁到较高的激发态 B.电子从较高的激发态跃迁到基态
C.焰色反应的光谱属于吸收光谱 D.焰色反应的光谱属于发射光谱
(2)镓(Ga)的价层电子排布式为
(3)
 的空间构型为
的空间构型为A.离子键 B.极性键 C.非极性键 D.配位键
(4)近年来,人们发现了双氢键,双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。下列不可能形成双氢键的是
A.Be—H……H—O B.O—H……H—N
C.Si—H……H—Al D.B—H……H—N
(5)从结构的角度解释:MgCO3热分解温度低于CaCO3热分解温度的原因是
(6)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa(镧)的合金可吸附H2的质量为

②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg处于乙图八个小立方体的体心。若晶体的密度为ρg/cm3,NA是阿伏加德罗常数,则Mg原子与Ni原子的最短距离为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为IVA族元素,单质Sn与干燥Cl2反应生成SnCl4。SnCl4空间构型为_______ 。
(2)基态As原子的核外电子排布式为_______ 。
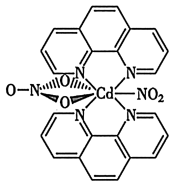
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有_______ mol,该螯合物中N的杂化方式有_______ 种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞梭边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
一个晶胞中有_______ 个Sn,找出距离Cd(0,0,0)最近的Sn_______ (用分数坐标表示)。 CdSnAs2晶体中与单个Sn键合的As有_______ 个。
(1)Sn为IVA族元素,单质Sn与干燥Cl2反应生成SnCl4。SnCl4空间构型为
(2)基态As原子的核外电子排布式为
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有

(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞梭边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。

| 坐标原子 | x | y | z |
| Cd | 0 | 0 | 0 |
| Sn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】我国科学家在铁基超导研究方面取得了一系列的重大突破,标志着我国在凝聚态物理领域已经成为一个强国。LiZnAs 是研究铁基超导材料的重要前体。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为_____ 。
(2)AsF3分子的空间构型为_____ ,As 原子的杂化轨道类型为_____ 。
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为_____ ,配原子为_____ 。
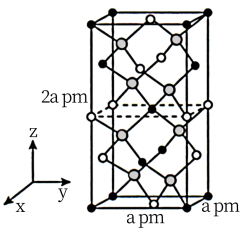
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为__________ ,阴离子的平均配位数与纯粹的 NiO 晶体相比____________ (填“增大”“减小”或“不变””,写出能体现镍元素化合价的该晶体的化学式________ 示例:Fe3O4写作 Fe2+Fe23+O4)。
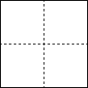
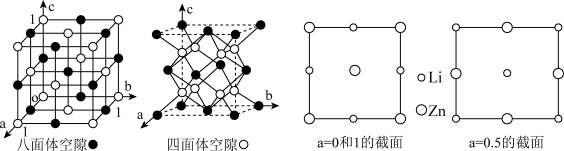
(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,______________ 并说明 a=__________ 。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为
(2)AsF3分子的空间构型为
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为

(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,


您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
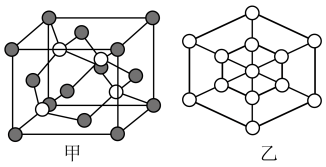
【推荐2】硼和镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。用于制氢的氨硼烷是非常有应用潜力的车载储氢材料之一,氨硼烷水解释放氢气,在催化剂存在条件下进行,该反应是氢元素间的归中反应,其反应方程式为:NH3BH3+2H2O= +
+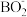 +3H2↑。回答下列问题:
+3H2↑。回答下列问题:
(1)基态B原子的最高能级电子排布式为___________ 。
(2)NH3BH3中所含元素电负性由大到小的顺序为___________ ,氨硼烷比其等电子体乙烷熔点高,原因是___________ 。
(3)反应方程式中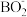 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出
中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出 的结构式:
的结构式:___________ 。
(4)一种含镓的药物合成方法如图所示:

①化合物Ⅰ中环上N原子的杂化方式为___________ ,1mol化合物Ⅰ中含有的C-H和C-Cσ键的数目共为___________ NA。
②化合物Ⅱ中Ga的配位数为___________ ,x=___________ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图甲所示,已知该晶体的密度为ρg/cm3),设NA是阿伏加德罗常数的值,若P原子半径为apm,晶胞中B、P原子相切,则B原子半径为___________ pm(写计算表达式);磷化硼晶胞沿着体对角线方向的投影(图乙中○表示P原子的投影),在图乙中用●画出B原子的投影位置___________ 。
 +
+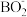 +3H2↑。回答下列问题:
+3H2↑。回答下列问题:(1)基态B原子的最高能级电子排布式为
(2)NH3BH3中所含元素电负性由大到小的顺序为
(3)反应方程式中
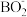 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出
中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出 的结构式:
的结构式:(4)一种含镓的药物合成方法如图所示:

①化合物Ⅰ中环上N原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图甲所示,已知该晶体的密度为ρg/cm3),设NA是阿伏加德罗常数的值,若P原子半径为apm,晶胞中B、P原子相切,则B原子半径为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】最近科研人员发现,用[Ni(cyclam)]2+(结构如图a)作电催化剂、二茂铁(结构如图c)作为牺牲电子供体,NH4PF6作为电解质和质子供体,CH3CN作溶剂,可实现有效催化还原CO2。
回答下列问题:
(1)基态Ni原子转化为基态Ni2+失去_______ 轨道的电子;基态Fe原子核外电子排布式为_______ 。
(2)NH4PF6中NH 空间构型为
空间构型为_______ ;N、P、F的电负性由大到小的顺序为_______ 。
(3)CH3CN分子中碳原子杂化方式为_______ 。
(4)已知3个及以上原子构成的离子团或分子中,原子有彼此平行的未参与杂化的p轨道电子,连贯重叠在一起构成π型化学键,又称为大π键,可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为 。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为
。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为_______ 。
(5)[Ni (cyclam)]2+可由某些镍的化合物与cyclam 反应制得。[Ni(cyclam)]2+中,Ni2+的配位数为_______ ;cyclam可溶于水,而环十四烷不溶于水,其原因是_______ 。
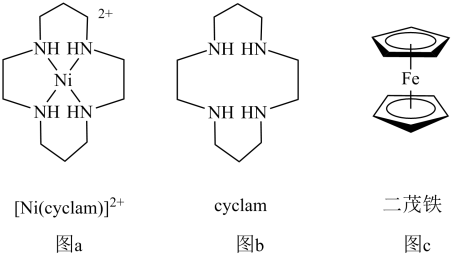
(6)某镍、砷晶体结构如图所示。该晶体的密度为_______ g·cm-3(列出计算式即可)。

回答下列问题:
(1)基态Ni原子转化为基态Ni2+失去
(2)NH4PF6中NH
 空间构型为
空间构型为(3)CH3CN分子中碳原子杂化方式为
(4)已知3个及以上原子构成的离子团或分子中,原子有彼此平行的未参与杂化的p轨道电子,连贯重叠在一起构成π型化学键,又称为大π键,可用符号
 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为 。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为
。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为(5)[Ni (cyclam)]2+可由某些镍的化合物与cyclam 反应制得。[Ni(cyclam)]2+中,Ni2+的配位数为
(6)某镍、砷晶体结构如图所示。该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】中医药作为中国优秀传统文化的典范,凝聚着祖先的智慧和经验的结晶。矿物药的成分主要为金属﹑金属氧化物﹑盐等。
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁[Fe(CH3COO)2],其形成的血红素分子结构如图1。铁华粉中基态亚铁离子的未成对电子数与其电子总数之比为_____ ,铁华粉中组成元素的电负性由大到小的顺序为_____ (填元素符号),血红素分子中铁(II)的配位数为_____ ,相同物质的量的铁华粉和血红素分子中sp3杂化的碳原子数目比为_____ 。

(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。熔点CaO_____ MgO(填“大于”或“小于”),请解释原因:_____ 。
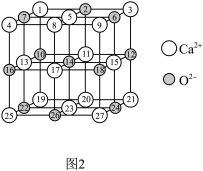
(3)CaO的晶胞为NaCl型晶胞,图2所示的晶胞结构中微粒位置错误的编号为_____ ,Ca2+的配位数为_____ ,若两个最近的Ca2+的距离为apm,则晶胞的密度为_____ g/cm3(NA为阿伏加德罗常数的值)。
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁[Fe(CH3COO)2],其形成的血红素分子结构如图1。铁华粉中基态亚铁离子的未成对电子数与其电子总数之比为

(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。熔点CaO
(3)CaO的晶胞为NaCl型晶胞,图2所示的晶胞结构中微粒位置错误的编号为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单晶氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
(1). 基态镍原子的核外电子排布式为_______ 。
(2). 氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为_______ ﹔在上述三种物质的分子中碳原子杂化类型不同于其他两种的是_______ ,立体构型为正四面体的分子是_______ ,三种物质中沸点最高的是CH3OH,其原因是_______ 。
(3). Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是_______ ,Ni(CO)4晶体类型是_______ 。
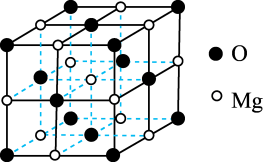
(4). 已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgО晶胞边长为0.42nm,则MgO的密度为_______ g/cm3(保留小数点后一位)。
(1). 基态镍原子的核外电子排布式为
(2). 氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为
(3). Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是
(4). 已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgО晶胞边长为0.42nm,则MgO的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】Fe、Co、Ni、Cu、Ag是一系列合金的重要金属元素。
(1)Fe元素位于周期表的_______ 区,基态 其核外电子有多少种空间运动状态
其核外电子有多少种空间运动状态_______ ;元素周期表中,铜、银位于同一副族相邻周期,则基态银原子的价层电子排布式为_______ 。
(2)照相底片定影时,常用定影液硫代硫酸钠( )溶解未曝光的溴化银(AgBr),生成含
)溶解未曝光的溴化银(AgBr),生成含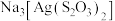 的废定影液。
的废定影液。 离子结构如图所示,其中心硫原子的杂化方式为
离子结构如图所示,其中心硫原子的杂化方式为_______ ,基态S原子中,核外电子占据的最高能级的符号是_______ ,占据最高能级电子的电子云轮廓图为_______ 形。

(3)Co可形成 配合物,1mol
配合物,1mol 中含有σ键的数目为
中含有σ键的数目为_______ 。
(4)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为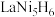 ,晶胞如图所示,则Z表示的微粒为
,晶胞如图所示,则Z表示的微粒为_______ (填化学式),晶胞参数=_______ pm。(用代数式表示,已知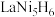 的摩尔质量为
的摩尔质量为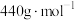 ,晶体密度为
,晶体密度为 ,
, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
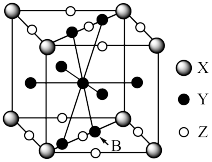
(1)Fe元素位于周期表的
 其核外电子有多少种空间运动状态
其核外电子有多少种空间运动状态(2)照相底片定影时,常用定影液硫代硫酸钠(
 )溶解未曝光的溴化银(AgBr),生成含
)溶解未曝光的溴化银(AgBr),生成含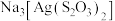 的废定影液。
的废定影液。 离子结构如图所示,其中心硫原子的杂化方式为
离子结构如图所示,其中心硫原子的杂化方式为
(3)Co可形成
 配合物,1mol
配合物,1mol 中含有σ键的数目为
中含有σ键的数目为(4)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为
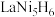 ,晶胞如图所示,则Z表示的微粒为
,晶胞如图所示,则Z表示的微粒为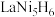 的摩尔质量为
的摩尔质量为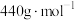 ,晶体密度为
,晶体密度为 ,
, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】锑(Sb)与砷为同族相邻元素。锑的氟化物SbF5溶于液态HF可形成一种酸性比硫酸强2×1019倍的酸HSbF6,向酸中通入H2S气体,可以得到催化剂、材料中间剂SH3SbF6。
回答下列问题:
(1)基态锑原子价电子的轨道表达式为______ ,基态锑原子第一电离能大于其同周期右侧相邻元素的原因为______ 。
(2)SbF5是一种具有立体结构的非极性分子,则其空间结构为_____ 。
(3)HF与H2S中沸点较高的是______ (填化学式),原因为_____ 。
(4)下列对SH3SbF6阴离子中心原子的杂化方式推断合理的是_____ (填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
(5)HSbF6强烈腐蚀石英,不能用玻璃、陶瓷容器盛装。图I为石英晶体的结构模型,则晶体中最小的环上原子个数为______ 个;石英晶胞为立方晶胞,图II为石英晶胞的结构示意图,图中“○”表示的为_____ (填“硅原子”或“氧原子”),若其密度为ρg•cm-3,则晶胞中距离最近的两个硅原子之间的距离为______ nm(用含ρ、NA的式子表示,列出计算式即可)。
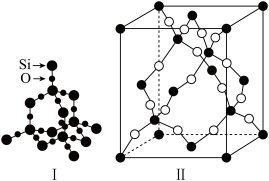
回答下列问题:
(1)基态锑原子价电子的轨道表达式为
(2)SbF5是一种具有立体结构的非极性分子,则其空间结构为
(3)HF与H2S中沸点较高的是
(4)下列对SH3SbF6阴离子中心原子的杂化方式推断合理的是
a.sp2 b.sp3 c.sp3d d.sp3d2
(5)HSbF6强烈腐蚀石英,不能用玻璃、陶瓷容器盛装。图I为石英晶体的结构模型,则晶体中最小的环上原子个数为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】回答下列问题:
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆( )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。
)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。
①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 。表示与之相反的用
。表示与之相反的用 表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为_______ 。
②Cd与Zn同族,价电子数相同,若配离子 的中心离子价电子数与配体提供的电子数之和为18,则x=
的中心离子价电子数与配体提供的电子数之和为18,则x=_______ 。
③碲和硫同主族,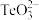 的空间构型为
的空间构型为_______ 。
(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如图),氧化石墨烯中键角
_______ (填“>”、“<”或=”)键角 ,原因是:
,原因是:_______ 。
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的_______ (填“四面体”、“八面体”或“立方体)空隙中。若晶胞边长为apmB原子半径为bpm,N原子半径为cpm,则该晶胞的空间利用率为:_______ (列出计算式)。

(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(
 )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。
)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 。表示与之相反的用
。表示与之相反的用 表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为②Cd与Zn同族,价电子数相同,若配离子
 的中心离子价电子数与配体提供的电子数之和为18,则x=
的中心离子价电子数与配体提供的电子数之和为18,则x=③碲和硫同主族,
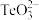 的空间构型为
的空间构型为(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如图),氧化石墨烯中键角

 ,原因是:
,原因是:
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的

您最近一年使用:0次
【推荐3】A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大。其中元素E的基态3d轨道上有2个电子,A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物。请回答下列问题:
(1)E的基态原子价层电子排布式为______________________________________ 。
(2)AB2分子中,A的杂化类型为___________ ;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)_________ ;1个AB2分子中,含有______ 个π 键和______ 个σ键。
(3)AB2形成的晶体的熔点_________ (填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是____________________________ .
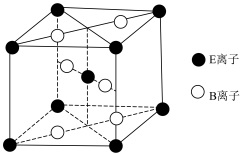
(4)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为______ (用元素符号表示)。 ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:______________ .
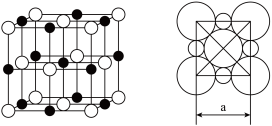
(5)由C、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:若a=5.6×10-8cm,则该晶体的密度为____________ g·cm-3。(精确到小数点后1位)。
(1)E的基态原子价层电子排布式为
(2)AB2分子中,A的杂化类型为
(3)AB2形成的晶体的熔点
(4)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为

(5)由C、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:若a=5.6×10-8cm,则该晶体的密度为

您最近一年使用:0次



