23-24高二下·全国·课前预习
解题方法
1 . 四原子分子的空间结构
大多数四原子分子采取_______ 形和_______ 形两种空间结构。
大多数四原子分子采取
| 化学式 | 电子式 | 结构式 | 键角 | 空间结构模型 | 空间结构名称 |
| CH2O | 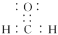 | 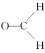 | 约 |  | |
| NH3 | 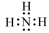 | 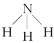 |  |
您最近一年使用:0次
解题方法
2 . ABm型分子的价电子对数的计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
价电子对数目(n)=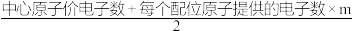
(1)中心原子的价电子数=___________ ;
(2)配位原子提供的价电子数:
卤素原子、氢原子按提供1个价电子数计算,O、S作为配位原子时按不提供价电子计算。如PCl5中n=___________ 。
(3)对于复杂离子,在计算价电子对数时,还应加上或减去离子所带的电荷数。如 中n=
中n=___________ , 中n=
中n=___________ 。
(4)若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理。如NO2中n=________ 。
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
价电子对数目(n)=
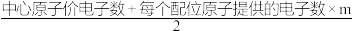
(1)中心原子的价电子数=
(2)配位原子提供的价电子数:
卤素原子、氢原子按提供1个价电子数计算,O、S作为配位原子时按不提供价电子计算。如PCl5中n=
(3)对于复杂离子,在计算价电子对数时,还应加上或减去离子所带的电荷数。如
 中n=
中n= 中n=
中n=(4)若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理。如NO2中n=
您最近一年使用:0次
解题方法
3 . 价层电子对互斥模型的基本要点
(1)价电子对:包括孤电子对和成键电子对,即价电子对数=_______ +_______ 。在价层电子对互斥模型中,成键电子对数等于成键数目,不用区别单键还是双键。
(2)价电子对的几何构型:
分子中的价电子对由于相互排斥作用,而趋向于尽可能___________ 以减小斥力,分子尽可能采取___________ 的空间构型。
价电子对数分别为2、3、4时,价电子对的几何分布分别为______ 、_______ 、_______ 。
(1)价电子对:包括孤电子对和成键电子对,即价电子对数=
(2)价电子对的几何构型:
分子中的价电子对由于相互排斥作用,而趋向于尽可能
价电子对数分别为2、3、4时,价电子对的几何分布分别为
您最近一年使用:0次
解题方法
4 . H2O分子的空间构型
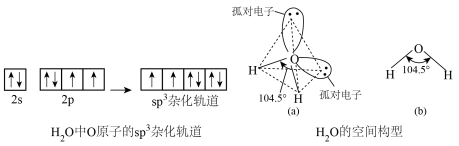
(1)杂化轨道类型:O原子上的1个2s轨道与3个2p轨道混合,形成4个_______ 化轨道,杂化轨道的空间构型是_______ 。
(2)成键情况:O原子的2个_______ 杂化轨道分别与H原子的_______ 轨道重叠,形成2个_______ 键,_______ 对孤电子对没有参加成键。
(3)空间构型:由于孤电子对—成键电子对的排斥作用_______ 成键电子对—成键电子对作用,使键角_______ 109°28'。H2O分子的空间构型为_______ ,键角为104°30'。

(1)杂化轨道类型:O原子上的1个2s轨道与3个2p轨道混合,形成4个
(2)成键情况:O原子的2个
(3)空间构型:由于孤电子对—成键电子对的排斥作用
您最近一年使用:0次
解题方法
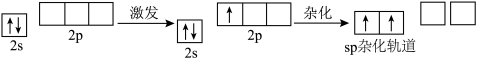
5 . sp杂化与BeCl2分子的空间构型
(1)杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,_______ 个2s轨道和_______ 个2p轨道发生杂化,形成_______ 相等、_______ 相同的_______ 个sp杂化轨道。

Be原子的sp杂化轨道呈_______ ,其夹角为_______ 。
(2)共价键的形成
Be原子的2个_______ 轨道分别与2个Cl原子的1个_______ 轨道重叠形成2个相同的_______ 键。
(3)BeCl2分子的空间构型
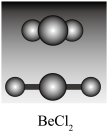
BeCl2分子为空间构型为_______ ,分子中Be—Cl键之间的夹角为_______ 。
(1)杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,


Be原子的sp杂化轨道呈
(2)共价键的形成
Be原子的2个
(3)BeCl2分子的空间构型

BeCl2分子为空间构型为
您最近一年使用:0次
6 . 分子的立体构型与键角的关系:
| 分子类型 | 键角 | 立体构型 | 实例 |
| AB2 | 180° | CO2、BeCl2、CS2 | |
| <180° | H2O、H2S | ||
| AB3 | 120° | BF3、BCl3 | |
| <120° | NH3、H3O+、PH3 | ||
| AB4 | 109°28′ | CH4、NH 、CCl4 、CCl4 |
您最近一年使用:0次



