23-24高二下·全国·课前预习
解题方法
1 . 四原子分子的空间结构
大多数四原子分子采取_______ 形和_______ 形两种空间结构。
大多数四原子分子采取
| 化学式 | 电子式 | 结构式 | 键角 | 空间结构模型 | 空间结构名称 |
| CH2O | 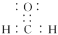 | 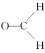 | 约 | 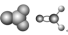 | |
| NH3 | 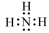 | 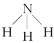 | 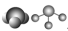 |
您最近半年使用:0次
23-24高二下·全国·课前预习
2 . VSEPR模型与中心原子的杂化轨道类型
| VSEPR模型 | 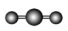 | 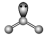 | 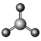 | 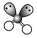 |  | 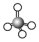 |
| VSEPR模型名称 | 直线形 | 平面三角形 | 平面三角形 | 四面体 | 四面体 | 正四面体 |
| 中心原子的杂化轨道类型 | ||||||
| 典例 | SO2 | SO3 | H2O | NH3 | CH4 |
您最近半年使用:0次
3 . 等电子原理
(1)等电子原理概念:
具有相同___________ 和相同___________ 的分子或离子具有相同的___________ 特征。符这一原理称为“等电子原理”。
(2)等电子原理的应用:
①判断一些简单分子或离子的立体结构:SiCl4、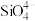 、
、 互为等电子体,空间结构为
互为等电子体,空间结构为___________ 。
②判断分子的结构性质:CO和N2,它们的分子中价电子总数是___________ ,都形成1个σ键和2个π键,CO的结构式为___________ ,CO和N2键能都___________ ,性质也相似。
③等电子原理在制造新材料方面的应用:晶体硅、锗、磷化铝(AlP)、砷化镓(GaAs)互为等电子体,都是良好的___________ 材料。
(1)等电子原理概念:
具有相同
(2)等电子原理的应用:
①判断一些简单分子或离子的立体结构:SiCl4、
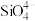 、
、 互为等电子体,空间结构为
互为等电子体,空间结构为②判断分子的结构性质:CO和N2,它们的分子中价电子总数是
③等电子原理在制造新材料方面的应用:晶体硅、锗、磷化铝(AlP)、砷化镓(GaAs)互为等电子体,都是良好的
您最近半年使用:0次
解题方法
4 . 分子空间构型
(1)孤电子对数=0的分子空间构型
(2)孤电子对、成键电子对之间斥力大小的顺序为:
___________ 之间的斥力>___________ 之间的斥力>___________ 之间的斥力。
(3)填写下表:
(1)孤电子对数=0的分子空间构型
| 价电子对数 | 价电子对的几何构型 | 分子的空间构型 | 实例 |
 | 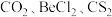 | ||
 | 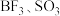 | ||
 | 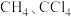 |
(3)填写下表:
| 分子 | 价电子对数 | 成键电子对数 | 孤电子对数 | 分子的空间构型 | 键角 | 同类型分子 |
| CH4 | 109.5° | |||||
| NH3 | 107.3° | |||||
| H2O | 104.5° |
您最近半年使用:0次
解题方法
5 . 价电子对数与中心原子的杂化轨道类型
(1)价电子对数相同,中心原子的杂化轨道类型___________ ,价电子对分布的几何构型___________ 。即价电子对数=___________ 。
(2)CH4、NH3、H2O分子的价电子对数都是___________ ,中心原子的杂化轨道数目为___________ ,杂化类型为___________ 杂化,价电子对分布的几何构型为___________ 。
(1)价电子对数相同,中心原子的杂化轨道类型
(2)CH4、NH3、H2O分子的价电子对数都是
您最近半年使用:0次
解题方法
6 . ABm型分子的价电子对数的计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
价电子对数目(n)=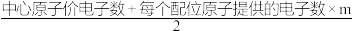
(1)中心原子的价电子数=___________ ;
(2)配位原子提供的价电子数:
卤素原子、氢原子按提供1个价电子数计算,O、S作为配位原子时按不提供价电子计算。如PCl5中n=___________ 。
(3)对于复杂离子,在计算价电子对数时,还应加上或减去离子所带的电荷数。如 中n=
中n=___________ , 中n=
中n=___________ 。
(4)若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理。如NO2中n=________ 。
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
价电子对数目(n)=
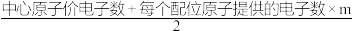
(1)中心原子的价电子数=
(2)配位原子提供的价电子数:
卤素原子、氢原子按提供1个价电子数计算,O、S作为配位原子时按不提供价电子计算。如PCl5中n=
(3)对于复杂离子,在计算价电子对数时,还应加上或减去离子所带的电荷数。如
 中n=
中n= 中n=
中n=(4)若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理。如NO2中n=
您最近半年使用:0次
解题方法
7 . 价层电子对互斥模型的基本要点
(1)价电子对:包括孤电子对和成键电子对,即价电子对数=_______ +_______ 。在价层电子对互斥模型中,成键电子对数等于成键数目,不用区别单键还是双键。
(2)价电子对的几何构型:
分子中的价电子对由于相互排斥作用,而趋向于尽可能___________ 以减小斥力,分子尽可能采取___________ 的空间构型。
价电子对数分别为2、3、4时,价电子对的几何分布分别为______ 、_______ 、_______ 。
(1)价电子对:包括孤电子对和成键电子对,即价电子对数=
(2)价电子对的几何构型:
分子中的价电子对由于相互排斥作用,而趋向于尽可能
价电子对数分别为2、3、4时,价电子对的几何分布分别为
您最近半年使用:0次
解题方法
8 . 中心原子轨道杂化类型的判断。
(1)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28',则中心原子发生_______ 杂化;若杂化轨道之间的夹角为120°,则中心原子发生_______ 杂化;若杂化轨道之间的夹角为180°,则中心原子发生_______ 杂化。
(2)有机化合物分子中碳原子杂化类型的判断:饱和碳原子采取 sp3 杂化,连接双键的碳原子采取sp²杂化,连接三键的碳原子采取 sp杂化。
(1)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28',则中心原子发生
(2)有机化合物分子中碳原子杂化类型的判断:饱和碳原子采取 sp3 杂化,连接双键的碳原子采取sp²杂化,连接三键的碳原子采取 sp杂化。
您最近半年使用:0次
解题方法
9 . H2O分子的空间构型
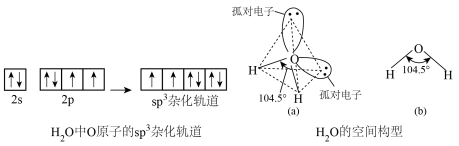
(1)杂化轨道类型:O原子上的1个2s轨道与3个2p轨道混合,形成4个_______ 化轨道,杂化轨道的空间构型是_______ 。
(2)成键情况:O原子的2个_______ 杂化轨道分别与H原子的_______ 轨道重叠,形成2个_______ 键,_______ 对孤电子对没有参加成键。
(3)空间构型:由于孤电子对—成键电子对的排斥作用_______ 成键电子对—成键电子对作用,使键角_______ 109°28'。H2O分子的空间构型为_______ ,键角为104°30'。

(1)杂化轨道类型:O原子上的1个2s轨道与3个2p轨道混合,形成4个
(2)成键情况:O原子的2个
(3)空间构型:由于孤电子对—成键电子对的排斥作用
您最近半年使用:0次
解题方法
10 . sp杂化与BeCl2分子的空间构型
(1)杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,_______ 个2s轨道和_______ 个2p轨道发生杂化,形成_______ 相等、_______ 相同的_______ 个sp杂化轨道。
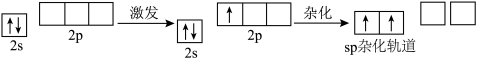

Be原子的sp杂化轨道呈_______ ,其夹角为_______ 。
(2)共价键的形成
Be原子的2个_______ 轨道分别与2个Cl原子的1个_______ 轨道重叠形成2个相同的_______ 键。
(3)BeCl2分子的空间构型
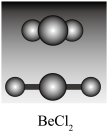
BeCl2分子为空间构型为_______ ,分子中Be—Cl键之间的夹角为_______ 。
(1)杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,


Be原子的sp杂化轨道呈
(2)共价键的形成
Be原子的2个
(3)BeCl2分子的空间构型

BeCl2分子为空间构型为
您最近半年使用:0次



