名校
解题方法
1 . 过渡金属氧化物离子(以MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下图所示。不正确 的是
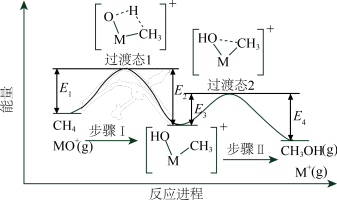
| A.反应速率:步骤I<步骤II |
| B.CH3OH分子中,键角:H—C—H>H—O—C |
| C.若MO+与CH3D反应,生成的氘代甲醇有2种 |
D.CH4(g) + MO+(g)=CH3OH(g) + M+(g)  = E2+E4-E1-E3 = E2+E4-E1-E3 |
您最近半年使用:0次
今日更新
|
336次组卷
|
3卷引用:江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题
江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
解题方法
2 . 下列说法正确的是
| A.杂化轨道只用于形成σ键 |
B. 分子N原子的杂化方式为 分子N原子的杂化方式为 |
C. 的VSEPR模型为三角锥形 的VSEPR模型为三角锥形 |
D.HF分子间氢键可表示为: |
您最近半年使用:0次
名校
解题方法
3 . 用价层电子对互斥理论 可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断正确的是
可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断正确的是
 可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断正确的是
可以预测许多分子或离子的立体构型,有时也能用来推测键角大小,下列判断正确的是| A.SO2、CS2都是直线形的分子 | B.键角由大到小顺序:CH4>NH3>H2O |
| C.BF3、NH3都是平面三角形的分子 | D.PCl3、SO3都是三角锥形的分子 |
您最近半年使用:0次
名校
4 . 侯氏制碱法的基本反应为NaCl + H2O + NH3 + CO2 = NaHCO3↓ + NH4Cl。下列说法正确的是
A.Na+的结构示意图为 | B.CO2的空间构型为V形 |
C.NH3的电子式为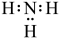 | D.NaHCO3既含离子键又含共价键 |
您最近半年使用:0次
名校
解题方法
5 . 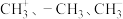 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是
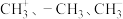 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是A.它们的碳原子均采取 杂化,其中 杂化,其中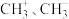 的结构示意图分别为: 的结构示意图分别为: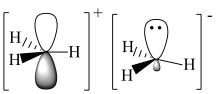 |
B. 与 与 形成的化合物中含有离子键 形成的化合物中含有离子键 |
C. 的键角和比 的键角和比 的键角小 的键角小 |
D. 与 与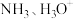 互为等电子体,VSEPR立体构型均为四面体形 互为等电子体,VSEPR立体构型均为四面体形 |
您最近半年使用:0次
名校
解题方法
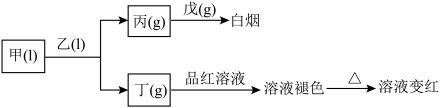
6 . X、Y、Z、W、Q为短周期主族元素,原子序数依次增大且原子序数总和等于49.它们的化合物在常温下有如图所示的转化关系: 杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中, 。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
(1)Q元素原子的简化电子排布式为___________ 。
(2)甲、乙、丙、丁、戊五种分子中,中心原子杂化方式为 的是
的是___________ (填分子的化学式);乙中共价键的键角小于戊中共价键的键角的原因是___________ 。
(3)戊分子为___________ 分子(填“极性”或“非极性”),甲分子的VSEPR模型为___________ 。
(4)写出甲与乙反应的化学方程式:___________ 。
(5)下列说法正确的是___________ (填序号)。
A.简单阴离子半径:W>Q
B.常温下,0.1 简单氢化物水溶液的pH:Q>W>Z>Y
简单氢化物水溶液的pH:Q>W>Z>Y
C.最高价氧化物对应水化物的酸性:Q>W
D.化合物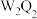 中含极性键、非极性键和离子键
中含极性键、非极性键和离子键
E.甲与乙的化学反应中,甲作氧化剂
 杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中, 。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:(1)Q元素原子的简化电子排布式为
(2)甲、乙、丙、丁、戊五种分子中,中心原子杂化方式为
 的是
的是(3)戊分子为
(4)写出甲与乙反应的化学方程式:
(5)下列说法正确的是
A.简单阴离子半径:W>Q
B.常温下,0.1
 简单氢化物水溶液的pH:Q>W>Z>Y
简单氢化物水溶液的pH:Q>W>Z>YC.最高价氧化物对应水化物的酸性:Q>W
D.化合物
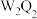 中含极性键、非极性键和离子键
中含极性键、非极性键和离子键E.甲与乙的化学反应中,甲作氧化剂
您最近半年使用:0次
名校
解题方法
7 . 燃油汽车尾气中含有CO和氮氧化物,在 的催化作用下,发生反应:
的催化作用下,发生反应: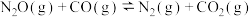 ,可降低污染。其反应历程和相对能量变化如图所示:
,可降低污染。其反应历程和相对能量变化如图所示:不正确 的是
 的催化作用下,发生反应:
的催化作用下,发生反应: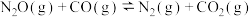 ,可降低污染。其反应历程和相对能量变化如图所示:
,可降低污染。其反应历程和相对能量变化如图所示: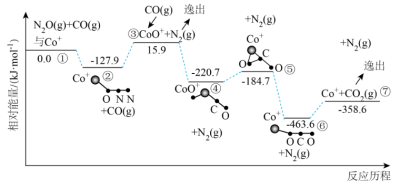
A. 分子的中心原子是N,分子中O—N—N的键角大于 分子的中心原子是N,分子中O—N—N的键角大于 分子中O—N—O的键角 分子中O—N—O的键角 |
| B.历程中决定反应速率的变化过程是②→③ |
C.总反应分两步进行,已知 参与第一步反应,则第二步反应为: 参与第一步反应,则第二步反应为: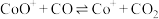 |
D.恒容、绝热下模拟反应: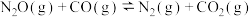 ,体系的温度、 ,体系的温度、 (平均相对分子质量)、压强恒定均能说明反应达到平衡状态 (平均相对分子质量)、压强恒定均能说明反应达到平衡状态 |
您最近半年使用:0次
名校
解题方法
8 . 利用反应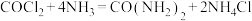 可去除
可去除 。下列说法正确的是
。下列说法正确的是
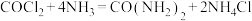 可去除
可去除 。下列说法正确的是
。下列说法正确的是A. 分子中碳原子轨道的杂化方式为 分子中碳原子轨道的杂化方式为 杂化 杂化 | B. 中只含离子键和配位键 中只含离子键和配位键 |
C.基态O原子的核外电子排布式为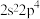 | D. 的空间构型为正四面体 的空间构型为正四面体 |
您最近半年使用:0次
名校
解题方法
9 . 实验室可由Ca(OH)2与NH4Cl反应制备NH3,同时生成CaCl2和H2O。下列说法正确的是
A.NH4Cl的电子式为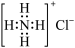 | B.H2O的空间构型为直线形 |
| C.CaCl2中只含有离子键 | D.键角大小: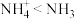 |
您最近半年使用:0次
解题方法
10 . Ⅰ.MnS纳米粒子被广泛应用于除去重金属离子中的铬离子。
(1)锰的价层电子排布式为______ 。
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-______ S2-(填“>”“<”或“=”)。H3O+中H—O—H的键角比H2O中的______ (填“大”或“小”)
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为______ ,Mn与CO的C原子形成配位键,该配合物的配位数为______ ,配体NH3的空间结构为______ (用文字描述)。
Ⅱ.
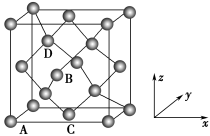
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为______ 。

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为______ 。已知金刚石的晶胞参数为apm,则其密度为______ g·cm-3(列出计算式)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为
Ⅱ.
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
您最近半年使用:0次



