名校
解题方法
1 . 下列分子或离子的空间结构和中心原子的杂化方式均正确的是
A. 平面三角形 平面三角形  杂化 杂化 | B. 平面三角形 平面三角形  杂化 杂化 |
C. V形 V形  杂化 杂化 | D. 三角锥形 三角锥形  杂化 杂化 |
您最近一年使用:0次
2024-04-21更新
|
243次组卷
|
7卷引用:四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题
四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题(已下线)期中模拟预测卷02(测试范围:选择性必修2+选择性必修3第1章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)天津市第三中学2022-2023学年高二下学期期中质量检测化学试题天津市静海区四校2022-2023学年高二下学期3月阶段性检测化学试题陕西省渭南市华州区咸林中学2023-2024学年高二下学期第一次月考化学试题浙江省舟山中学2023-2024学年高二下学期4月月考化学试题福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题
解题方法
2 . Ⅰ.MnS纳米粒子被广泛应用于除去重金属离子中的铬离子。
(1)锰的价层电子排布式为______ 。
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-______ S2-(填“>”“<”或“=”)。H3O+中H—O—H的键角比H2O中的______ (填“大”或“小”)
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为______ ,Mn与CO的C原子形成配位键,该配合物的配位数为______ ,配体NH3的空间结构为______ (用文字描述)。
Ⅱ.
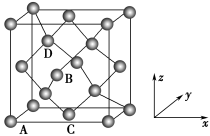
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为______ 。

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为______ 。已知金刚石的晶胞参数为apm,则其密度为______ g·cm-3(列出计算式)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为
Ⅱ.
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
您最近一年使用:0次
名校
3 . NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_____ 。
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_____ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_____ 。
②NaHCO3分解得Na2CO3., 空间结构为
空间结构为_____ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3的中心原子的杂化轨道类型为_____ 。
②比较熔点:NH3BH3_____ CH3CH3(填“>”或“<”)。
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_____ 。
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是_____ 。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3.,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N | F |
| 电负性 | 2.1 | 2.0 | 3.0 | 4.0 |
②比较熔点:NH3BH3
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是
您最近一年使用:0次
2024-03-03更新
|
275次组卷
|
2卷引用:北京市第十九中学2021-2022学年高二下学期期中考试化学试题
解题方法
4 . 下列化学用语使用正确的是
A.乙烯的电子式: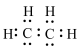 | B. 的离子结构示意图: 的离子结构示意图: |
| C.Fe2+的价层电子排布式:3d5 | D.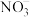 的空间结构:平面三角形 的空间结构:平面三角形 |
您最近一年使用:0次
解题方法
5 . 下列说法正确的是
A. 和 和 的中心原子的价层电子对数均为4 的中心原子的价层电子对数均为4 |
B. 能与 能与 以配位键结合是因为 以配位键结合是因为 中氮原子有孤电子对 中氮原子有孤电子对 |
C. 的熔点高于 的熔点高于 是因为 是因为 键的键能比 键的键能比 大 大 |
D.氨水中存在 是因为 是因为 是离子化合物 是离子化合物 |
您最近一年使用:0次
名校
解题方法
6 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)SiCl4可发生水解反应,机理如下:
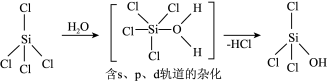
含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为___________ (填标号)。
(3)CS2分子中存在___________ 个σ键和___________ 个π键。
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
(5)FeCO3的阴离子的空间构型为___________ ,写出一种与该阴离子互为等电子体的分子的化学式___________ 。
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为___________ ,羰基镍属于___________ 晶体。已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(3)CS2分子中存在
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(5)FeCO3的阴离子的空间构型为
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为
您最近一年使用:0次
名校
解题方法
7 . 磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子的价层电子排布图为
___________ 。
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是
___________ (填字母序号)。
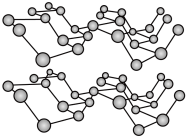
a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为 杂化
杂化
(3) 与水会形成黄色的配离子
与水会形成黄色的配离子
 ,为避免颜色干扰,常在
,为避免颜色干扰,常在
 溶液中加入
溶液中加入
 形成无色的
形成无色的
 。由此推测,与
。由此推测,与
 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是
___________ ,其空间结构是
___________ 。
(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
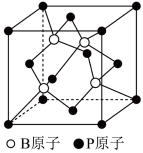
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于___________ 晶体,其熔点差异的主要原因是___________ 。
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是___________  (列出表达式)。
(列出表达式)。
(1)基态磷原子的价层电子排布图为
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是

a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为
 杂化
杂化(3)
 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在
,为避免颜色干扰,常在 溶液中加入
溶液中加入 形成无色的
形成无色的 。由此推测,与
。由此推测,与 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为
 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
解题方法
8 . 实验室制备乙炔的反应为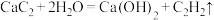 。下列说法
。下列说法不正确 的是
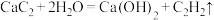 。下列说法
。下列说法A.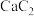 的电子式为 的电子式为 |
B. 的中心原子采取 的中心原子采取 杂化 杂化 |
C. 中含有离子键和共价键 中含有离子键和共价键 |
D. 的空间结构为直线形 的空间结构为直线形 |
您最近一年使用:0次
名校
解题方法
9 . SiH4与NH3制备氮化硅(熔点1900℃)的反应为 ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是| A.熔点:单晶硅>氮化硅 | B.未成对电子数:Si<N |
| C.键角:SiH4>NH3 | D.NH3是由极性键构成的三角锥形分子 |
您最近一年使用:0次
名校
解题方法
10 . 碳族元素中的Sn和氧族元素中的Te的有机化合物受到广泛关注。文献报道了利用有八面体结构的有机碲酸A与三甲基氯化锡B合成了一种具有抗癌活性的含碲和锡有机化合物C,反应前后Te和Sn的杂化方式不变。请回答下列问题:

(1)Te原子的最高能层理论上所具有的轨道数为_____ 。
(2)气态TeO3分子的立体构型为_____ ;共价化合物B中Sn的杂化方式为_____ 。化合物A中Te与下列化合物中S的杂化方式相同的是_____ (填序号)。
①H2S ②SO2③SO3④SF6
(3)用一个溴原子和一个氯原子取代有机碲酸A中与Te相连的两个羟基,结构仍为八面体,取代后的有机碲酸可能有_____ 种。
(4)有机化合物C核磁共振氢谱显示等效氢的个数比为_____ 。
(5)化合物B可以用SnI4合成,α-SnI4为立方晶体,其晶胞沿面对角线的投影如图所示:
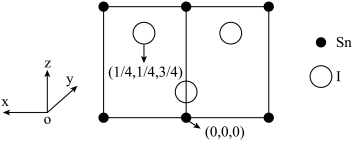
①晶胞中Sn和I之间的最近距离为apm,α-SnI4的密度的计算式为_____ g/cm3(设阿伏加德罗常数为NA);晶胞中由碘原子所围成的空隙中心坐标为_____ 。
②常温常压下SiF4为气态而SiCl4为液态,原因____ ,SnF4和SnCl4都为离子晶体,而SnF4为固体,SiCl4为液体,这是由于F到Cl的变化使得与Sn的卤化物中化学键的离子性____ 、共价性____ 。(填“增强”“不变”或“减弱”)

(1)Te原子的最高能层理论上所具有的轨道数为
(2)气态TeO3分子的立体构型为
①H2S ②SO2③SO3④SF6
(3)用一个溴原子和一个氯原子取代有机碲酸A中与Te相连的两个羟基,结构仍为八面体,取代后的有机碲酸可能有
(4)有机化合物C核磁共振氢谱显示等效氢的个数比为
(5)化合物B可以用SnI4合成,α-SnI4为立方晶体,其晶胞沿面对角线的投影如图所示:

①晶胞中Sn和I之间的最近距离为apm,α-SnI4的密度的计算式为
②常温常压下SiF4为气态而SiCl4为液态,原因
您最近一年使用:0次



