磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子的价层电子排布图为
___________ 。
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是
___________ (填字母序号)。
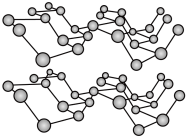
a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为 杂化
杂化
(3) 与水会形成黄色的配离子
与水会形成黄色的配离子
 ,为避免颜色干扰,常在
,为避免颜色干扰,常在
 溶液中加入
溶液中加入
 形成无色的
形成无色的
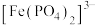 。由此推测,与
。由此推测,与
 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是
___________ ,其空间结构是
___________ 。
(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
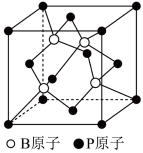
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于___________ 晶体,其熔点差异的主要原因是___________ 。
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是___________  (列出表达式)。
(列出表达式)。
(1)基态磷原子的价层电子排布图为
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是

a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为
 杂化
杂化(3)
 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在
,为避免颜色干扰,常在 溶液中加入
溶液中加入 形成无色的
形成无色的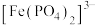 。由此推测,与
。由此推测,与 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为
 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是 (列出表达式)。
(列出表达式)。
更新时间:2023-09-24 19:31:19
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
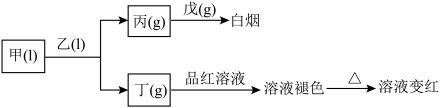
【推荐1】X、Y、Z、W、Q为短周期主族元素,原子序数依次增大且原子序数总和等于49.它们的化合物在常温下有如图所示的转化关系: 杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中, 。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
(1)Q元素原子的简化电子排布式为___________ 。
(2)甲、乙、丙、丁、戊五种分子中,中心原子杂化方式为 的是
的是___________ (填分子的化学式);乙中共价键的键角小于戊中共价键的键角的原因是___________ 。
(3)戊分子为___________ 分子(填“极性”或“非极性”),甲分子的VSEPR模型为___________ 。
(4)写出甲与乙反应的化学方程式:___________ 。
(5)下列说法正确的是___________ (填序号)。
A.简单阴离子半径:W>Q
B.常温下,0.1 简单氢化物水溶液的pH:Q>W>Z>Y
简单氢化物水溶液的pH:Q>W>Z>Y
C.最高价氧化物对应水化物的酸性:Q>W
D.化合物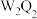 中含极性键、非极性键和离子键
中含极性键、非极性键和离子键
E.甲与乙的化学反应中,甲作氧化剂
 杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中, 。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:(1)Q元素原子的简化电子排布式为
(2)甲、乙、丙、丁、戊五种分子中,中心原子杂化方式为
 的是
的是(3)戊分子为
(4)写出甲与乙反应的化学方程式:
(5)下列说法正确的是
A.简单阴离子半径:W>Q
B.常温下,0.1
 简单氢化物水溶液的pH:Q>W>Z>Y
简单氢化物水溶液的pH:Q>W>Z>YC.最高价氧化物对应水化物的酸性:Q>W
D.化合物
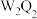 中含极性键、非极性键和离子键
中含极性键、非极性键和离子键E.甲与乙的化学反应中,甲作氧化剂
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】研究发现,铜基催化剂可以促进二氧化碳(CO2)转换成一氧化碳(CO)、甲醛(CH2O)或乙烯(CH2=CH2)及乙醇(CH3CH2OH)等多碳化合物,对于“碳达峰”和“碳中和”目标的顺利实现具有积极推动作用。
(1)Cu基态原子核外电子排布式为___________ ,该元素位于元素周期表第___________ 族,属于___________ 区。
(2)下列说法正确的是___________ (填序号)
a.H2O、CH4、CO2的沸点:H2O>CO2>CH4
b.CH4分子中含有极性键,是极性分子
c.CH2=CH2、CH2O分子中碳原子的杂化方式不同
d.根据价层电子互斥理论,CH2O,H2O,BF3,SO3分子中,H2O的中心原子价层电子对数不同于其他分子
(3)已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,写出两个与CO2具有相同空间构型的分子或者离子___________ 。
(4)在海洋生物作用下形成CaCO3,亦是减缓大气中CO2增加的主要途径。CaCO3中的化学键除了σ键外,还存在___________ 和大π键,CO 大π键应表示为
大π键应表示为___________ 。(大π键可用符号Π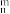 表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π
表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π )
)
(5)铜基催化剂铁表面上铁原子吸附离解的碳原子局部示意图如图所示(图中小黑球代表碳原子,灰球代表铜原子)。则催化剂表面上C/Cu原子数比为___________ 。

(6)已和CO2在高温高压下所形成的晶体的晶胞如图所示,CO2的晶胞参数(棱长)apm,其密度为bg•cm-3,则阿伏加德罗常数为___________ (列出计算式即可)。
(1)Cu基态原子核外电子排布式为
(2)下列说法正确的是
a.H2O、CH4、CO2的沸点:H2O>CO2>CH4
b.CH4分子中含有极性键,是极性分子
c.CH2=CH2、CH2O分子中碳原子的杂化方式不同
d.根据价层电子互斥理论,CH2O,H2O,BF3,SO3分子中,H2O的中心原子价层电子对数不同于其他分子
(3)已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,写出两个与CO2具有相同空间构型的分子或者离子
(4)在海洋生物作用下形成CaCO3,亦是减缓大气中CO2增加的主要途径。CaCO3中的化学键除了σ键外,还存在
 大π键应表示为
大π键应表示为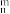 表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π
表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π )
)(5)铜基催化剂铁表面上铁原子吸附离解的碳原子局部示意图如图所示(图中小黑球代表碳原子,灰球代表铜原子)。则催化剂表面上C/Cu原子数比为

(6)已和CO2在高温高压下所形成的晶体的晶胞如图所示,CO2的晶胞参数(棱长)apm,其密度为bg•cm-3,则阿伏加德罗常数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铁及其化合物在化工、医药、材料等领域具有广泛应用,回答下列问题:
(1)Fe元素位于元素周期表的____ 区,与Fe同周期的所有元素的基态原子中,未成对电子数与Fe3+相同的元素有____ 种。
(2)FeCl3蒸汽状态下以双聚分子(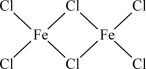 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是____ ;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+,结构如图所示。在该双核阳离子中,H—O—H键角____ (填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是____ 键(填“a”或“b”)。
(3)用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为____ ,K4[Fe(CN)6]中存在____ (填代号)。
a.离子键 b.氢键 c.配位键 d.金属键
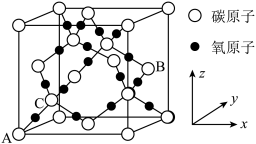
(4)Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为____ ;Fe4N晶胞中与N最近的Fe原子数为____ ;Fe与Fe之间的最短距离为____ cm。

(1)Fe元素位于元素周期表的
(2)FeCl3蒸汽状态下以双聚分子(
 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是
(3)用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为
a.离子键 b.氢键 c.配位键 d.金属键
(4)Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】 是一种锂离子电池的正极材料,放电时生成
是一种锂离子电池的正极材料,放电时生成 。
。
(1)下列电子排布图表示的Li原子的状态中,能量最高的为___________ (填序号)。___________ 。
(3) 的制备:
的制备:
 的结构如图1所示。
的结构如图1所示。 和
和 之间的作用力类型为
之间的作用力类型为___________ 。
② 的
的 大于
大于 的
的 ,从结构角度解释原因:
,从结构角度解释原因:___________ 。
(4)锂离子电池充放电过程中,正极材料晶胞的组成变化如图2所示。 的空间构型为
的空间构型为___________ ,且磷氧键键能较大,锂离子嵌入和脱出时,磷酸铁锂的空间骨架不易发生形变,具有良好的循环稳定性。
②正极材料在 和
和 之间转化时,经过中间产物
之间转化时,经过中间产物 。
。 转化为
转化为 的过程中,每摩晶胞转移电子的物质的量为
的过程中,每摩晶胞转移电子的物质的量为___________ 摩。
 是一种锂离子电池的正极材料,放电时生成
是一种锂离子电池的正极材料,放电时生成 。
。(1)下列电子排布图表示的Li原子的状态中,能量最高的为
a. b.
b. c.
c.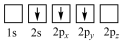
(3)
 的制备:
的制备:
 的结构如图1所示。
的结构如图1所示。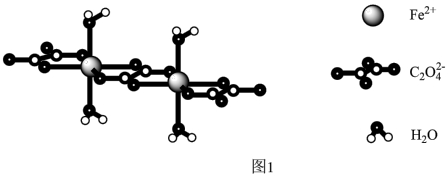
 和
和 之间的作用力类型为
之间的作用力类型为②
 的
的 大于
大于 的
的 ,从结构角度解释原因:
,从结构角度解释原因:(4)锂离子电池充放电过程中,正极材料晶胞的组成变化如图2所示。

 的空间构型为
的空间构型为②正极材料在
 和
和 之间转化时,经过中间产物
之间转化时,经过中间产物 。
。 转化为
转化为 的过程中,每摩晶胞转移电子的物质的量为
的过程中,每摩晶胞转移电子的物质的量为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】阿司匹林是临床上常用的一种药物,具有解热镇痛的作用,但是长时间服用会对肠胃造成伤害。科学家在阿司匹林的基础上对其结构进行进一步修饰,研制出长效缓释阿司匹林M(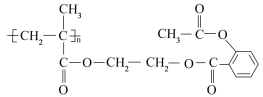 ),既可以保证药效,又可减轻胃肠道刺激反应。从三种基础原料出发,通过数步反应过程合成长效缓释阿司匹林,其分析过程具体如图所示。
),既可以保证药效,又可减轻胃肠道刺激反应。从三种基础原料出发,通过数步反应过程合成长效缓释阿司匹林,其分析过程具体如图所示。

已知:
(1)H的名称_________ ;C中官能团名称_________ 。
(2)D的结构简式为_________ ;其中采用 杂化的C原子个数有
杂化的C原子个数有_________ 个。
(3)I→J的反应类型_________ 。F→G的反应方程式为_________ 。
(4)D中含苯环且满足下列条件的同分异构体有_________ 种;
①苯环上只有两个取代基 ②能与碳酸钠溶液反应放出气体 ③能发生银镜反应
请写出其中含有手性碳结构的任意一种同分异构体的结构简式_________ 。
(5)以丙烯为起始原料制备丙酮酸甲酯(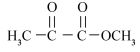 )的合成路线如下,请补充完整
)的合成路线如下,请补充完整_________ (无机试剂任选)。

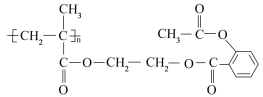 ),既可以保证药效,又可减轻胃肠道刺激反应。从三种基础原料出发,通过数步反应过程合成长效缓释阿司匹林,其分析过程具体如图所示。
),既可以保证药效,又可减轻胃肠道刺激反应。从三种基础原料出发,通过数步反应过程合成长效缓释阿司匹林,其分析过程具体如图所示。
已知:

(1)H的名称
(2)D的结构简式为
 杂化的C原子个数有
杂化的C原子个数有(3)I→J的反应类型
(4)D中含苯环且满足下列条件的同分异构体有
①苯环上只有两个取代基 ②能与碳酸钠溶液反应放出气体 ③能发生银镜反应
请写出其中含有手性碳结构的任意一种同分异构体的结构简式
(5)以丙烯为起始原料制备丙酮酸甲酯(
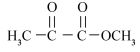 )的合成路线如下,请补充完整
)的合成路线如下,请补充完整
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
则,A的化合价_________ B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:

则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:______ ,原因是:________ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是_______ 。
(4)某配合物的分子结构如下图所示,

则N原子的杂化方式为_______ ;基态Ni原子的电子排布式________ 。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
则,A的化合价
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(4)某配合物的分子结构如下图所示,

则N原子的杂化方式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】根据所学内容填空:
(1)有下列物质:①HF、②Cl2、③H2Se、④CCl4、⑤BF3、⑥CS2,其中属于极性分子的是___ (填序号,下同),既有σ键又有π键的是___ 。
(2)下列分子中,空间构型为正四面体形且键角为109°28′的是__ 。
a.PCl3b.SiF4c.CH2F2d.P4e.CH4f.NH3
(3)下列分子或离子中不存在配位键的是__ 。
a.H3O+b.NH3c.Fe(SCN)2+d.Ni(CO)4e.[Cu(H2O)4]2+
(4)H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__ 。
(5)丙烯腈分子(H2C=CH—C≡N)中碳原子轨道杂化类型是__ 。
(6)如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___ (化学式)。

(1)有下列物质:①HF、②Cl2、③H2Se、④CCl4、⑤BF3、⑥CS2,其中属于极性分子的是
(2)下列分子中,空间构型为正四面体形且键角为109°28′的是
a.PCl3b.SiF4c.CH2F2d.P4e.CH4f.NH3
(3)下列分子或离子中不存在配位键的是
a.H3O+b.NH3c.Fe(SCN)2+d.Ni(CO)4e.[Cu(H2O)4]2+
(4)H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(5)丙烯腈分子(H2C=CH—C≡N)中碳原子轨道杂化类型是
(6)如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】 是一种高迁移率的新型热电材料,具有广泛的应用。回答下列问题:
是一种高迁移率的新型热电材料,具有广泛的应用。回答下列问题:
(1) 为第五周期、ⅣA族元素,其价层电子轨道表示式为
为第五周期、ⅣA族元素,其价层电子轨道表示式为_______ 。
(2)单质 与干燥的
与干燥的 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为_______ ,其固体的晶体类型为_______ 。
(3) 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为_______ (填化学式,下同),键能由大到小的顺序为_______ 。
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,
配合物的结构如图所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有_______  。
。

(5) 比
比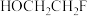 的熔沸点
的熔沸点_______ (填“高、低或相等”),原因是_______ 。
 是一种高迁移率的新型热电材料,具有广泛的应用。回答下列问题:
是一种高迁移率的新型热电材料,具有广泛的应用。回答下列问题:(1)
 为第五周期、ⅣA族元素,其价层电子轨道表示式为
为第五周期、ⅣA族元素,其价层电子轨道表示式为(2)单质
 与干燥的
与干燥的 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为(3)
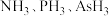 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,
配合物的结构如图所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有 。
。
(5)
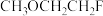 比
比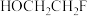 的熔沸点
的熔沸点
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】我国考古人员在秦陵挖掘的宝剑,到现在仍然锋利无比,原因是剑锋上覆盖了一层铬。铬能形成多种化合物,主要化合价有+2价、+3价、+6价。
请回答下列问题:
(1)基态铬原子的外围电子排布式为_______ ;与铬同周期的所有元素中,基态原子最高能层电子数与铬原子未成对电子数相同的元素是_______ 。
(2)铬原子的各级电离能(I:kJ·mol-1)数据如下表所示:
铬原子逐级电离能增大的原因是_______ 。
(3)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种暗绿色固体与足量硝酸银反应时,1mol 固体可生成1mol氯化银沉淀。则这种暗绿色固体的化学式为_______ ,其中铬的配体水分子的VSEPR模型为_______ ,该配合物中存在的作用力有_______ (填标号)。
A.离子键 B.配位键 C.共价键 D.金属键
(4)CrO3能将乙醇氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是_______ 。
(5)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示:
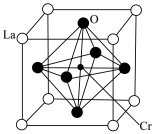
①该晶体的化学式为_______ 。
②该晶体中距离镧原子最近的铬原子有_______ 个;若两个距离最近的氧原子核间距为a pm,组成物质的摩尔质量为b g·mol-1,阿伏伽德罗常数值为NA,则晶体密度的表达式为_______ g·cm-3。
请回答下列问题:
(1)基态铬原子的外围电子排布式为
(2)铬原子的各级电离能(I:kJ·mol-1)数据如下表所示:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(3)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种暗绿色固体与足量硝酸银反应时,1mol 固体可生成1mol氯化银沉淀。则这种暗绿色固体的化学式为
A.离子键 B.配位键 C.共价键 D.金属键
(4)CrO3能将乙醇氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是
(5)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示:

①该晶体的化学式为
②该晶体中距离镧原子最近的铬原子有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】科学家利用光催化剂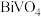 实现高选择性制备氢气。某小组以辉铋矿(主要成分是
实现高选择性制备氢气。某小组以辉铋矿(主要成分是 ,含少量
,含少量 、
、 、
、 和
和 等杂质)为原料制备钒酸铋(
等杂质)为原料制备钒酸铋(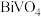 )的流程如下:
)的流程如下:
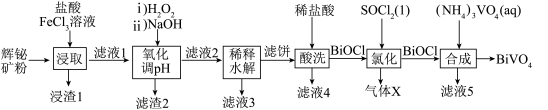
已知:
①滤液1中所含阳离子主要有 、
、 、
、 和
和 。
。
②几种氢氧化物沉淀的 如表所示。
如表所示。
回答下列问题:
(1)滤渣2的主要成分是_______ (填化学式)。将辉铋矿粉碎过筛制成矿粉,其目的是_______ 。
(2)“酸洗”中用盐酸代替水的目的是_______ 。滤液3可以循环用于“_______ ”工序(填名称)。
(3)“氯化”的化学方程式为_______ 。
(4)“合成”过程中将 溶液和
溶液和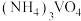 溶液混合容易形成
溶液混合容易形成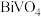 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为_______ (任答一条)。
(5) 的立方晶胞结构如图所示。已知晶体密度为
的立方晶胞结构如图所示。已知晶体密度为 ,设
,设 为阿伏加德罗常数的值,则该晶体中与
为阿伏加德罗常数的值,则该晶体中与 距离最近且相等的
距离最近且相等的 有
有_______ 个,相邻2个 的核间距为
的核间距为_______ nm。

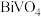 实现高选择性制备氢气。某小组以辉铋矿(主要成分是
实现高选择性制备氢气。某小组以辉铋矿(主要成分是 ,含少量
,含少量 、
、 、
、 和
和 等杂质)为原料制备钒酸铋(
等杂质)为原料制备钒酸铋(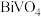 )的流程如下:
)的流程如下:
已知:
①滤液1中所含阳离子主要有
 、
、 、
、 和
和 。
。②几种氢氧化物沉淀的
 如表所示。
如表所示。| 氢氧化物 |  |  |  |
开始沉淀 | 7.5 | 2.3 | 4.0 |
沉淀完全 | 9.7 | 3.7 |
(1)滤渣2的主要成分是
(2)“酸洗”中用盐酸代替水的目的是
(3)“氯化”的化学方程式为
(4)“合成”过程中将
 溶液和
溶液和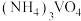 溶液混合容易形成
溶液混合容易形成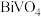 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为(5)
 的立方晶胞结构如图所示。已知晶体密度为
的立方晶胞结构如图所示。已知晶体密度为 ,设
,设 为阿伏加德罗常数的值,则该晶体中与
为阿伏加德罗常数的值,则该晶体中与 距离最近且相等的
距离最近且相等的 有
有 的核间距为
的核间距为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______ 。
(2)①1 mol丙酮(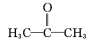 )分子中含有σ键的数目为
)分子中含有σ键的数目为_______ 。(设NA为阿伏加德罗常数的值)
②乙醇的沸点高于丙酮,这是因为_______ 。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是_______ (填“分子晶体”或“离子晶体”)。
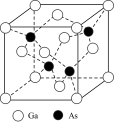
(4)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565 pm。晶体的密度为_______ (设NA为阿伏伽德罗常数的数值,列出算式即可)g·cm-3。
(1)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(2)①1 mol丙酮(
 )分子中含有σ键的数目为
)分子中含有σ键的数目为②乙醇的沸点高于丙酮,这是因为
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是
(4)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565 pm。晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】一种新型硫酸盐功能电解液由 和
和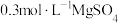 混合组成,电化学测试表明该电解液构建的
混合组成,电化学测试表明该电解液构建的 、
、 电池可以稳定循环500次以上。
电池可以稳定循环500次以上。
(1) 中三种原子的半径由小到大的顺序是
中三种原子的半径由小到大的顺序是_____ (用元素符号表示),其中电负性最大的元素是_____ (填名称)。
(2)第一电离能 的原因是
的原因是_____ 。
(3) 中,基态
中,基态 核外电子的空间运动状态有
核外电子的空间运动状态有_____ 种, 中
中 键和
键和 键的数目之比为
键的数目之比为_____ 。
(4) 中磷原子的杂化类型是
中磷原子的杂化类型是_____ 。
(5)N、O两种元素形成的简单氢化物的键角:
_____  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_____ 。
(6) 的立方晶胞结构如图所示。已知晶胞的边长为npm,设
的立方晶胞结构如图所示。已知晶胞的边长为npm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
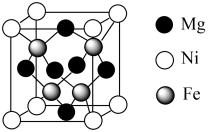
①
_____ 。
②该晶体密度是_____  (用含n、
(用含n、 的代数式表示)。
的代数式表示)。
 和
和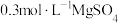 混合组成,电化学测试表明该电解液构建的
混合组成,电化学测试表明该电解液构建的 、
、 电池可以稳定循环500次以上。
电池可以稳定循环500次以上。(1)
 中三种原子的半径由小到大的顺序是
中三种原子的半径由小到大的顺序是(2)第一电离能
 的原因是
的原因是(3)
 中,基态
中,基态 核外电子的空间运动状态有
核外电子的空间运动状态有 中
中 键和
键和 键的数目之比为
键的数目之比为(4)
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的键角:

 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是(6)
 的立方晶胞结构如图所示。已知晶胞的边长为npm,设
的立方晶胞结构如图所示。已知晶胞的边长为npm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①
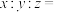
②该晶体密度是
 (用含n、
(用含n、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



