名校
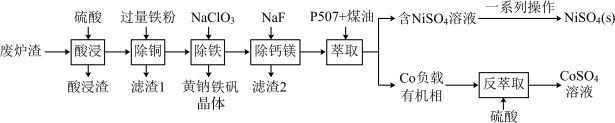
1 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式________ , 空间构型为
空间构型为________
(2)提高“酸浸”速率的方法有_________ 。(任写一条)
(3)“滤渣1”的主要成分是_________ 。(写化学式)
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F- )最小为______ mol·L-1(已知离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全,Ksp(CaF2)=1.0 ×10-10,Ksp(MgF2)=7.5×10-11)。
(6)获得NiSO4(s)的“一系列操作”是________ 。
(7)工艺流程中,可循环利用的物质是___________ 。
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式
 空间构型为
空间构型为(2)提高“酸浸”速率的方法有
(3)“滤渣1”的主要成分是
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(6)获得NiSO4(s)的“一系列操作”是
(7)工艺流程中,可循环利用的物质是
您最近一年使用:0次
名校
解题方法
2 . Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________ 。
(2)配合物K4Fe(CN)6的中心离子是____________ ,该离子价电子的基态电子排布图为____________ 。
(3)lmol HCN分子中含有σ键的数目为____________ ,HCN分子中碳原子轨道杂化类型是____________ ,与CN-互为等电子体的阴离子是____________ 。
(4)K2CO3中阴离子的空间构型为____________ ,其中碳原子的价层电子对数为____________ 。
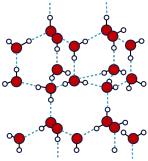
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________ 个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________ (用NA表示阿伏加德罗常数的值)。
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为
(2)配合物K4Fe(CN)6的中心离子是
(3)lmol HCN分子中含有σ键的数目为
(4)K2CO3中阴离子的空间构型为
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有

您最近一年使用:0次
2017-05-07更新
|
498次组卷
|
4卷引用:福建省莆田第一中学2017届高三考前模拟(最后一卷)化学试题



