解题方法
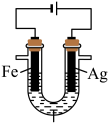
1 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制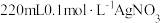 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: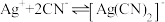 ,
,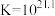 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是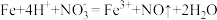 和
和___________ (用离子方程式表示,已知氧化性: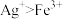 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中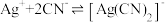 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为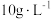 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为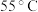 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由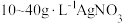 溶液和
溶液和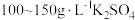 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: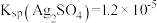 。
。
I.实验准备。
(1)用
 固体配制
固体配制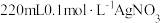 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
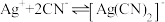 ,
,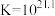 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
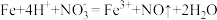 和
和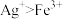 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
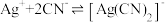 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(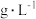 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为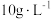 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
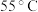 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
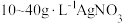 溶液和
溶液和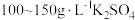 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
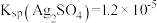 。
。
您最近一年使用:0次
2024-04-16更新
|
318次组卷
|
5卷引用:2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学
2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
2 . 某小组设计一系列实验探究SO2和AgNO3溶液反应的原理。回答下列问题: 已知:Ag+能与NH3·H2O反应生成稳定的络合物[Ag(NH3)2]+。
实验(一):制备SO2并完成SO2和AgNO3溶液反应。
已知:常温下,实验室用70%浓硫酸与亚硫酸钠粉末反应制备SO2。

实验中,硝酸银溶液中产生大量白色沉淀,过滤得到灰白色沉淀A和无色溶液B。
(1)制备SO2的发生装置宜选择___________(填标号)。
(2)饱和NaHSO3溶液的作用是___________ 。
实验(二):探究灰白色沉淀A的成分。
步骤1:向沉淀A中加入足量的浓氨水,灰白色沉淀逐渐减少,得到灰黑色浊液。
步骤2:静置一段时间,取上层清液于试管中,加入浓硝酸,产生红棕色气体。
(3)经检验,灰黑色浊液中的固体是银单质,则每生成1 mol银转移的电子的物质的量为___________ mol。
(4)灰白色沉淀A与浓氨水发生反应的离子方程式为___________ (写出一个即可)。
实验(三):探究无色溶液B的成分。
已知:AgCl溶于浓盐酸生成[AgCl2]-
操作与现象:
将无色溶液B分成两份,向一份溶液中滴加浓盐酸,先产生白色沉淀,后沉淀溶解;向另一份溶液中加入饱和Na2SO3溶液,试管中无沉淀产生。
(5)补充实验:向0.1 mol •L-1的AgNO3溶液中滴加饱和Na2SO3溶液,有白色沉淀产生。由此推知,无色溶液B中___________ (填“存在”或“不存在”) Ag+。
(6)经检验发现此溶液中含有[Ag(SO3)2]3-,用平衡移动原理解释向溶液B中滴加浓盐酸出现白色沉淀的原因:___________ 。
(7)取少量无色溶液B,滴加盐酸酸化的氯化钡溶液,产生白色沉淀,有同学认为是由于空气中的O2参与了反应,设计实验探究该同学的猜想:___________ 。
(8)通过上述实验,可以推出SO2与AgNO3溶液反应包括氧化还原反应和复分解反应。由此推知:Fe3+和SO 不能大量共存的原因有两种:一种是2Fe3++3SO
不能大量共存的原因有两种:一种是2Fe3++3SO +6H2O=2Fe(OH)3↓+3H2SO3,另一种是
+6H2O=2Fe(OH)3↓+3H2SO3,另一种是___________ (用离子方程式表示)。
实验(一):制备SO2并完成SO2和AgNO3溶液反应。
已知:常温下,实验室用70%浓硫酸与亚硫酸钠粉末反应制备SO2。

实验中,硝酸银溶液中产生大量白色沉淀,过滤得到灰白色沉淀A和无色溶液B。
(1)制备SO2的发生装置宜选择___________(填标号)。
A.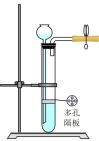 | B.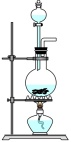 | C.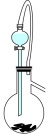 | D. |
实验(二):探究灰白色沉淀A的成分。
步骤1:向沉淀A中加入足量的浓氨水,灰白色沉淀逐渐减少,得到灰黑色浊液。
步骤2:静置一段时间,取上层清液于试管中,加入浓硝酸,产生红棕色气体。
(3)经检验,灰黑色浊液中的固体是银单质,则每生成1 mol银转移的电子的物质的量为
(4)灰白色沉淀A与浓氨水发生反应的离子方程式为
实验(三):探究无色溶液B的成分。
已知:AgCl溶于浓盐酸生成[AgCl2]-
操作与现象:
将无色溶液B分成两份,向一份溶液中滴加浓盐酸,先产生白色沉淀,后沉淀溶解;向另一份溶液中加入饱和Na2SO3溶液,试管中无沉淀产生。
(5)补充实验:向0.1 mol •L-1的AgNO3溶液中滴加饱和Na2SO3溶液,有白色沉淀产生。由此推知,无色溶液B中
(6)经检验发现此溶液中含有[Ag(SO3)2]3-,用平衡移动原理解释向溶液B中滴加浓盐酸出现白色沉淀的原因:
(7)取少量无色溶液B,滴加盐酸酸化的氯化钡溶液,产生白色沉淀,有同学认为是由于空气中的O2参与了反应,设计实验探究该同学的猜想:
(8)通过上述实验,可以推出SO2与AgNO3溶液反应包括氧化还原反应和复分解反应。由此推知:Fe3+和SO
 不能大量共存的原因有两种:一种是2Fe3++3SO
不能大量共存的原因有两种:一种是2Fe3++3SO +6H2O=2Fe(OH)3↓+3H2SO3,另一种是
+6H2O=2Fe(OH)3↓+3H2SO3,另一种是
您最近一年使用:0次
名校
3 . 三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:
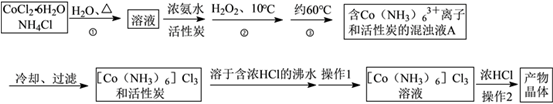
已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为_________ [Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH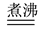 Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。

已知: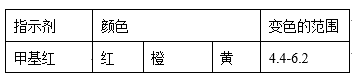
①当滴定到终点时,共需消耗NaOH溶液___ mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______ (填“偏大”、“偏小”或“不变”)
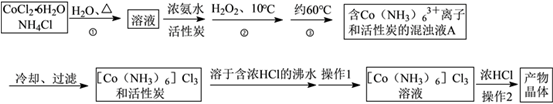
已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:
(3)实验操作1为
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH
 Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
已知:

①当滴定到终点时,共需消耗NaOH溶液
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将
您最近一年使用:0次
2017-12-31更新
|
442次组卷
|
3卷引用:河南省南阳市第一中学2018届高三上学期第八次考试理综化学试题