1 . 硒化锌是一种重要的半导体材料,其晶胞结构如图所示:

| A.质谱仪 | B.核磁共振仪 |
| C.红外光谱仪 | D.X射线衍射仪 |
您最近一年使用:0次
解题方法
2 . 一种纳米线的制备中使用到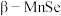 ,
,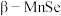 的结构中Se为面心立方最密堆积,晶胞结构如图所示。
的结构中Se为面心立方最密堆积,晶胞结构如图所示。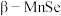 中距Mn最近的Se有
中距Mn最近的Se有_______ 个。
(2)若该晶体的晶胞边长为 ,阿伏加德罗常数为
,阿伏加德罗常数为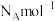 ,则
,则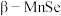 的密度为
的密度为_______ (列出表达式) 。
。
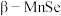 ,
,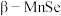 的结构中Se为面心立方最密堆积,晶胞结构如图所示。
的结构中Se为面心立方最密堆积,晶胞结构如图所示。
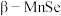 中距Mn最近的Se有
中距Mn最近的Se有(2)若该晶体的晶胞边长为
 ,阿伏加德罗常数为
,阿伏加德罗常数为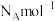 ,则
,则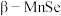 的密度为
的密度为 。
。
您最近一年使用:0次
3 . 纳米材料是指在三维空间中至少有一维处于纳米尺寸 或由它们作为基本单元构成的材料。一种纳米线的制备中使用到
或由它们作为基本单元构成的材料。一种纳米线的制备中使用到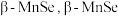 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。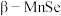 中距
中距 最近的
最近的 有
有_____ 个。
(2)若该晶体的晶胞边长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则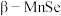 的密度为
的密度为_____ 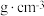 。
。
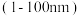 或由它们作为基本单元构成的材料。一种纳米线的制备中使用到
或由它们作为基本单元构成的材料。一种纳米线的制备中使用到 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。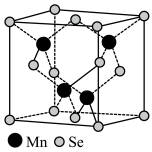
 中距
中距 最近的
最近的 有
有(2)若该晶体的晶胞边长为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 的密度为
的密度为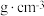 。
。
您最近一年使用:0次
23-24高二下·全国·课前预习
4 . 一个晶胞平均占有的原子数:_______ 、_______ 、_______ 。


您最近一年使用:0次
23-24高二下·全国·课前预习
5 . 常见离子晶体的结构
(1)NaCl晶胞
NaCl晶胞如图所示,每个Na+周围距离最近的Cl-有_______ 个(上、下、左、右、前、后各1个),构成正八面体,每个Cl-周围距离最近的Na+有_______ 个,构成正八面体,由此可推知晶体的化学式为NaCl。回答下列问题:
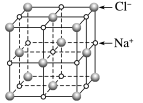
①每个Na+(Cl-)周围距离相等且最近的Na+(Cl-)是_______ 个。
②每个晶胞中实际拥有的Na+数是_______ 个,Cl-数是_______ 个。
③若晶胞参数为apm,则氯化钠晶体的密度为________ g•cm-3。
(2)CsCl晶胞
CsCl晶胞如图所示,每个Cs+周围距离最近的Cl-有_______ 个,每个Cl-周围距离最近的Cs+有_______ 个,它们均构成正六面体,由此可推知晶体的化学式为CsCl。回答下列问题:

①每个Cs+(Cl-)周围距离最近的Cs+(Cl-)有_______ 个,构成正八面体。
②每个晶胞中实际拥有的Cs+有_______ 个,Cl-有_______ 个。
③若晶胞参数为apm,则氯化铯晶体的密度为________ g•cm-3。
(1)NaCl晶胞
NaCl晶胞如图所示,每个Na+周围距离最近的Cl-有

①每个Na+(Cl-)周围距离相等且最近的Na+(Cl-)是
②每个晶胞中实际拥有的Na+数是
③若晶胞参数为apm,则氯化钠晶体的密度为
(2)CsCl晶胞
CsCl晶胞如图所示,每个Cs+周围距离最近的Cl-有

①每个Cs+(Cl-)周围距离最近的Cs+(Cl-)有
②每个晶胞中实际拥有的Cs+有
③若晶胞参数为apm,则氯化铯晶体的密度为
您最近一年使用:0次
6 . V2O5-WO3/TiO2催化剂可以催化NH3脱除烟气中的NO,反应为:4NO(g) + 4NH3(g) + O2(g)=4N2(g) + 6H2O(g)  =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧, 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为___________ ;在水溶液中VO 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为___________ 。
(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为___________ 。

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是___________ 。

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
则V2O5样品的纯度为___________ 。(写出计算过程)
 =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧,
 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为
 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO
 +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。则V2O5样品的纯度为
您最近一年使用:0次
名校
7 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于放热反应的是_____ (填字母)。
A. 碳与水蒸气反应
B. 铝和氧化铁反应
C. CaCO3受热分解
D. 氢气还原三氧化钨制取钨
E. 锌与盐酸反应
(2)获取能量变化的途径
①已知:
则:SiCl4(g)+2H2(g)= Si(s)+4HCl(g)的反应热
_____ 
②已知在常温常压下:
i、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)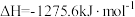
ii、H2O(l)=H2O(g)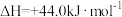
写出表示甲醇燃烧热的热化学方程式_____ 。
(3)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为____________ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。
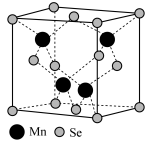
①β-MnSe中Mn的配位数为_______ 。
②Mn2+的价电子排布式为_______ 。
(1)下列反应中,属于放热反应的是
A. 碳与水蒸气反应
B. 铝和氧化铁反应
C. CaCO3受热分解
D. 氢气还原三氧化钨制取钨
E. 锌与盐酸反应
(2)获取能量变化的途径
①已知:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能(kJ·mol-1) | 460 | 360 | 436 | 431 | 176 | 347 |


②已知在常温常压下:
i、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)
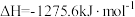
ii、H2O(l)=H2O(g)
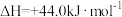
写出表示甲醇燃烧热的热化学方程式
(3)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。

①β-MnSe中Mn的配位数为
②Mn2+的价电子排布式为
您最近一年使用:0次
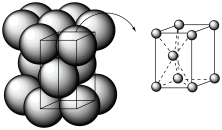
8 . 结合课本金属镁晶胞,计算镁晶胞中包含的微粒数_______ 。

您最近一年使用:0次
9 . 回答下列问题:
(1)苯胺(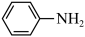 )的晶体类型是
)的晶体类型是_______ 。苯胺与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是_______ 。
(2)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于_______ 晶体。碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接_______ 个六元环,每个六元环占有_______ 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_______ 个六元环,六元环中最多有_______ 个C原子在同一平面。
(1)苯胺(
 )的晶体类型是
)的晶体类型是 )的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是(2)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于

①在石墨烯晶体中,每个C原子连接
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
您最近一年使用:0次
10 . 金属钨晶体中晶胞的结构模型如图所示。已知阿伏加德罗常数为NA,实际测得金属钨的密度为ρ,钨的摩尔质量为M,假定钨原子为等直径的刚性球,请回答下列问题:

(1)每一个晶胞分摊到___________ 个钨原子。
(2)晶胞的边长a为___________ 。
(3)钨的原子半径r为___________ (只有体对角线上的各个球才是彼此接触的)。
(4)金属钨原子形成的该晶胞的空间利用率为___________ 。

(1)每一个晶胞分摊到
(2)晶胞的边长a为
(3)钨的原子半径r为
(4)金属钨原子形成的该晶胞的空间利用率为
您最近一年使用:0次



