名校
解题方法
1 . 过二硫酸盐[例:(NH4)2S2O8、Na2S2O8]都具有强氧化性,可作为氧化剂和漂白剂,(NH4)2S2O8被广泛用于蓄电池工业,在照相工业上用来除去海波。
I.(NH4)2S2O8的制备原理为H2O2+2H2SO4+2NH3=(NH4)2S2O8+2H2O。实验室模拟制备(NH4)2S2O8的装置如图所示。
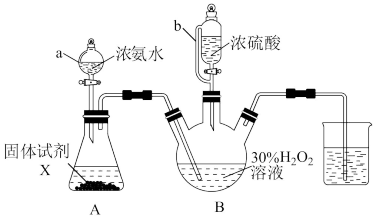
(1)仪器a的名称是________ 。
(2)充分反应后,将B中混合液经一系列操作得到晶体,用无水乙醚洗涤,目的是______ 。
(3)烘干产品时,用红外灯低温供干,可能的原因是_______ 。
II.(NH4)2S2O8的性质及应用。
(4)过二硫酸(H2S2O8)是一种强氧化性酸,在Ag+催化作用下, 能与Mn2+在水溶液中发生反应生成
能与Mn2+在水溶液中发生反应生成 和
和 ,1mol
,1mol 能氧化的Mn2+的物质的量为
能氧化的Mn2+的物质的量为_____ mol。过二硫酸铵可用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为 ),写出该反应的离子方程式
),写出该反应的离子方程式______ 。
III.标定(NH4)2S2O8溶液的浓度。
(5)称取一定质量的(NH4)2S2O8,配制成溶液,并用碘量法标定该溶液的浓度,移取20.00mL(NH4)2S2O8溶液于锥形瓶中,加入过量的KI,然后加入几滴淀粉溶液,再用0.1mol·L-1的Na2S2O3溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为
。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为______ ,所标定的(NH4)2S2O8的浓度为________ mol∙L-1。
I.(NH4)2S2O8的制备原理为H2O2+2H2SO4+2NH3=(NH4)2S2O8+2H2O。实验室模拟制备(NH4)2S2O8的装置如图所示。

(1)仪器a的名称是
(2)充分反应后,将B中混合液经一系列操作得到晶体,用无水乙醚洗涤,目的是
(3)烘干产品时,用红外灯低温供干,可能的原因是
II.(NH4)2S2O8的性质及应用。
(4)过二硫酸(H2S2O8)是一种强氧化性酸,在Ag+催化作用下,
 能与Mn2+在水溶液中发生反应生成
能与Mn2+在水溶液中发生反应生成 和
和 ,1mol
,1mol 能氧化的Mn2+的物质的量为
能氧化的Mn2+的物质的量为 ),写出该反应的离子方程式
),写出该反应的离子方程式III.标定(NH4)2S2O8溶液的浓度。
(5)称取一定质量的(NH4)2S2O8,配制成溶液,并用碘量法标定该溶液的浓度,移取20.00mL(NH4)2S2O8溶液于锥形瓶中,加入过量的KI,然后加入几滴淀粉溶液,再用0.1mol·L-1的Na2S2O3溶液滴定,发生反应:I2+2
 =2I-+
=2I-+ 。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为
。重复上述操作三次,平均消耗Na2S2O3溶液的体积为18.40mL,滴定终点时的颜色变化为
您最近一年使用:0次
2022-01-11更新
|
353次组卷
|
6卷引用:新疆昌吉州2021-2022学年高三上学期第二次高考质量检测化学试题
2021高三·浙江·专题练习
名校
解题方法
2 . 某酸性废液中含有Fe3+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对该废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
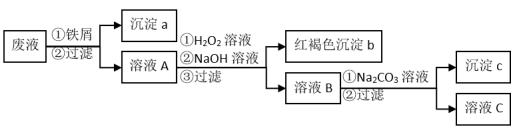
请回答:
(1)沉淀a中含有的单质是_____ 。
(2)沉淀c的化学式是_____ 。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_____ 。

请回答:
(1)沉淀a中含有的单质是
(2)沉淀c的化学式是
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是
您最近一年使用:0次
2021-10-19更新
|
346次组卷
|
3卷引用:新疆柯坪县柯坪湖州国庆中学2021-2022学年高三上学期第一次月考化学试题
新疆柯坪县柯坪湖州国庆中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题17.基础实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)新疆乌鲁木齐市第八中学2021-2022学年高一上学期第二次月考化学试题
3 . 海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等。如图为海水蒸馏原理示意图,请回答下列问题:

(1)冷却水的进水口是______ (填“a”或“b”);
(2)碎瓷片的作用是______ (填“防止暴沸”或“作催化剂”)。

(1)冷却水的进水口是
(2)碎瓷片的作用是
您最近一年使用:0次
4 . 用一种试剂除去下列各物质中的杂质。
(1)除去CO2中混有的HCl:试剂_________ ,其所发生的离子方程式为:__________________________ ;
(2)除去Fe2(SO4)3溶液中混有的FeSO4:试剂_________ ,其所发生的离子方程式为:_________________ ;
(3)除去NaHCO3溶液中混有的Na2CO3:试剂_________ ,其所发生的离子方程式为:_________________ ;
(1)除去CO2中混有的HCl:试剂
(2)除去Fe2(SO4)3溶液中混有的FeSO4:试剂
(3)除去NaHCO3溶液中混有的Na2CO3:试剂
您最近一年使用:0次
5 . 铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,写出该反应的化学方程式_____________ ,CeO2在该反应中作______ 剂。
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:________________ 。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是_________________ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得,操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________ 。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是_____________ ,调pH的目的是____________ 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是__________________ 。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,写出该反应的化学方程式
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得,操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
13-14高三上·北京海淀·期中
名校
解题方法
6 . 某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为___________ 、___________ 。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:___________ 。
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为___________ 。
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:

①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液___________ kg(用含a 的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:___________ 。
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:

①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液
②写出由Fe(OH)3制取Na2FeO4的化学方程式:
您最近一年使用:0次
2016-12-09更新
|
814次组卷
|
5卷引用:新疆维吾尔自治区阿克苏市高级中学2019届高三上学期第二次月考化学试题
新疆维吾尔自治区阿克苏市高级中学2019届高三上学期第二次月考化学试题(已下线)2014届北京市海淀区高三上学期期中考试化学试卷(已下线)2014高考名师推荐化学--预测15辽宁省大连育明高级中学、本溪市高级中学2018届高三10月月考化学(理)试题广西钦州市钦州港经济技术开发区中学2017-2018学年高一上学期(12月)月考化学试题



