名校
1 . 苯乙酸铜是合成优良催化剂、传感材料—纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:
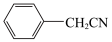
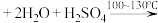
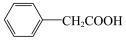

2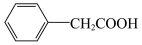
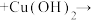 (
(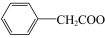 )
)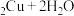
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。
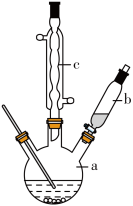
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是___________ ,其作用是___________ 。
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是___________ 。
(3)分离苯乙酸粗品的方法是___________ ,提纯粗苯乙酸的方法是___________ 。最终得到44g纯品,则苯乙酸的产率是___________ (保留两位有效数字)。
(4)用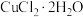 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________ 。


2
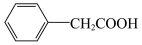
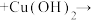 (
( )
)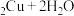
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
(3)分离苯乙酸粗品的方法是
(4)用
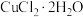 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2023-04-30更新
|
206次组卷
|
4卷引用:T28-实验题
名校
2 . 工业上利用焦炭和水蒸气发生如下的两个反应:①C(s)+H2O(g) CO(g)+H2(g)、②CO(g)+H2O(g)
CO(g)+H2(g)、②CO(g)+H2O(g) CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
 CO(g)+H2(g)、②CO(g)+H2O(g)
CO(g)+H2(g)、②CO(g)+H2O(g) CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是A.制备NH3 | B.干燥NH3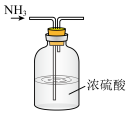 |
C.收集NH3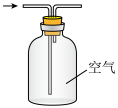 | D.吸收多余的NH3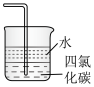 |
您最近一年使用:0次
2024-02-23更新
|
777次组卷
|
4卷引用:河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期3月月考化学试题
河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期3月月考化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题江苏省无锡市第一中学2023-2024学年高三上学期10月份质量检测化学试题
2021高三·全国·专题练习
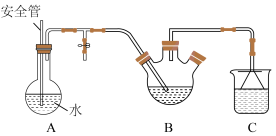
3 . 氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应,并产生同一种气体。回答下列问题:
Ⅰ.制备氢化锂(LiH):
选择图中的装置制备氢化锂(必要时可重复使用)。

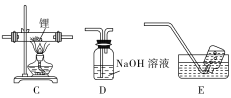
(1)装置D中NaOH溶液的作用是_______ 。
(2)装置的连接顺序(从左至右)为A→_______ 。
Ⅱ.制备氢化铝锂:1947年,Schlesinger、Bond 和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)将乙醚换为水是否可行,请简述理由:_______ 。
(4)氢化锂与无水三氯化铝反应的化学方程式为_______ 。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度。
(5)按图装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是_______ 。读数之前,上下移动量气管在右侧的容器,使量气管左、右两侧的液面在同一水平面上,其目的是_______ 。

(6)标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_______ (用含a、V1、V2的代数式表示)。若起始读数时俯视刻度线,测得的结果将_______ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备氢化锂(LiH):
选择图中的装置制备氢化锂(必要时可重复使用)。


(1)装置D中NaOH溶液的作用是
(2)装置的连接顺序(从左至右)为A→
Ⅱ.制备氢化铝锂:1947年,Schlesinger、Bond 和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)将乙醚换为水是否可行,请简述理由:
(4)氢化锂与无水三氯化铝反应的化学方程式为
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度。
(5)按图装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是

(6)标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为
您最近一年使用:0次
名校
解题方法
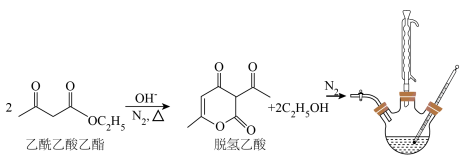
4 . 脱氢乙酸是一种重要的有机合成中间体和低毒高效食品防腐剂,实验室以乙酰乙酸乙酯为原料,在OH-的催化作用下制备脱氢乙酸的反应原理和实验装置如图(夹持和加热装置已省略):
Ⅰ.脱氢乙酸的合成
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是___________ 。
(2)步骤Ⅰ中②过程中不需要用到的仪器为___________ (填字母)。___________ ℃、___________ h、___________ 作催化剂。与其他催化剂相比,所选催化剂使脱氢乙酸产率最高的原因可能为___________ 。___________ ,漏斗的作用为___________ 。
(5)脱氢乙酸的产率约为___________(填字母)。
| 名称 | 相对分子质量 | 性状 | 密度/ | 熔点/℃ | 沸点/℃ | 物理性质 |
| 乙酰乙酸乙酯 | 130 | 无色透明液体 | 1.03 | -39 | 180.8 | 微溶于水,易溶于乙醇等有机溶剂 |
| 脱氢乙酸 | 168 | 白色晶体 | — | 109~111 | 269.9 | 微溶于乙醇和冷水,具有较强的还原性 |
| 乙醇 | 46 | 无色透明液体 | 0.79 | -114.1 | 78.3 | 与水任意比例互溶,易溶于有机溶剂 |
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是
(2)步骤Ⅰ中②过程中不需要用到的仪器为


(5)脱氢乙酸的产率约为___________(填字母)。
| A.54% | B.64% | C.74% | D.84% |
您最近一年使用:0次
2024-04-02更新
|
566次组卷
|
5卷引用:黑龙江省哈尔滨市三校联考2024届高三二模化学试题
黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)东北三省2024届高三下学期三校二模联考化学试题2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
名校
5 . 氮化钙(Ca3N2)是一种重要的化学试剂,某化学兴趣小组拟制备氮化钙并测定产品纯度。
已知:①氮化钙极易与水反应;
②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;
③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验:
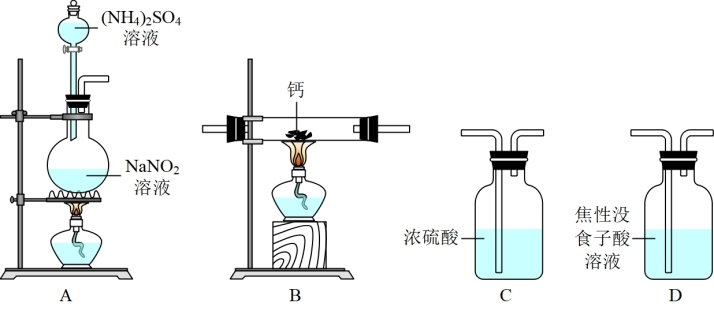
(1)装置A中反应容器的名称为___________ ,A中发生反应的离子方程式:___________ 。
(2)气体从左至右,装置连接顺序为___________ (填标号,装置可重复使用)。
(3)实验步骤如下:___________ (请按正确的顺序填入下列步骤的代号)。
①加热B处的酒精灯;
②检查装置气密性;
③打开分液漏斗活塞,加热A处的酒精灯;。
④停止加热A处的酒精灯;
⑤停止加热B处的酒精灯;
⑥装入药品。
II.测定产品纯度
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。
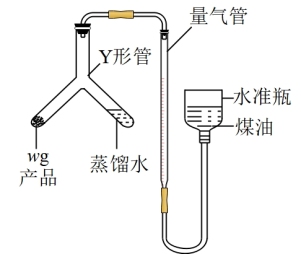
(4)氮化钙与水反应的化学方程式为___________ 。
(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。使产品与蒸馏水接触反应的操作是:将Y形管___________ (填“ 左倾”或“右倾”)。
(6)实验中取产品质量为w g,开始量气管读数为V1 mL(量气管“0”刻度线在仪器。上方),最终量气管读数为V2mL(折合成标准状况),则该样品纯度为___________ (用代数式表示)。如果开始仰视刻度线,终点时俯视刻度线,则测得结果___________ (填“ 偏高”“偏低”或“无影响”)。
已知:①氮化钙极易与水反应;
②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;
③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验:

(1)装置A中反应容器的名称为
(2)气体从左至右,装置连接顺序为
(3)实验步骤如下:
①加热B处的酒精灯;
②检查装置气密性;
③打开分液漏斗活塞,加热A处的酒精灯;。
④停止加热A处的酒精灯;
⑤停止加热B处的酒精灯;
⑥装入药品。
II.测定产品纯度
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。

(4)氮化钙与水反应的化学方程式为
(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。使产品与蒸馏水接触反应的操作是:将Y形管
(6)实验中取产品质量为w g,开始量气管读数为V1 mL(量气管“0”刻度线在仪器。上方),最终量气管读数为V2mL(折合成标准状况),则该样品纯度为
您最近一年使用:0次



