22-23高二下·云南曲靖·期中
名校
1 . 苯乙酸铜是合成优良催化剂、传感材料—纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:
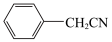
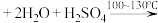
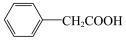

2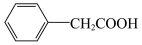
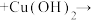 (
(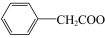 )
)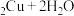
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。
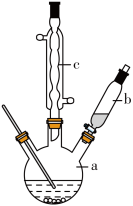
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是___________ ,其作用是___________ 。
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是___________ 。
(3)分离苯乙酸粗品的方法是___________ ,提纯粗苯乙酸的方法是___________ 。最终得到44g纯品,则苯乙酸的产率是___________ (保留两位有效数字)。
(4)用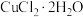 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________ 。

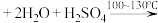
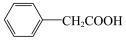

2
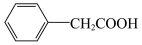
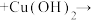 (
( )
)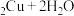
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
(3)分离苯乙酸粗品的方法是
(4)用
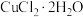 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2023-04-30更新
|
200次组卷
|
4卷引用:T28-实验题
名校
解题方法
2 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
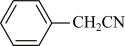


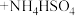
2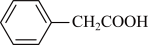
 (
(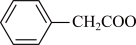 )
)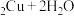
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
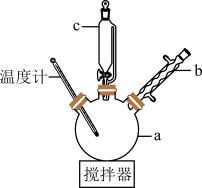
步骤一:将a中所加的硫酸溶液加热至100℃,缓缓滴入40.0g苯乙腈,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品并进行提纯。
步骤二:用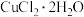 和
和 溶液制备适量
溶液制备适量 沉淀,并用蒸馏水多次洗涤沉淀。
沉淀,并用蒸馏水多次洗涤沉淀。
步骤三:将苯乙酸加入乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
回答下列问题:
(1)仪器a的名称是___________ 。仪器b的作用是___________ 。与普通分液漏斗相比,仪器c的优点是___________ 。
(2)制备苯乙酸时,最合适的加热方法是___________ (a.水浴,b.油浴,c.直接加热,填标号)。
(3)步骤一中加适量冷水的目的是___________ ,步骤三中加入乙醇的目的是___________ 。
(4)提纯粗苯乙酸的方法是___________ ,得到42.1g苯乙酸纯品,则苯乙酸的产率是___________ (保留三位有效数字)。



2
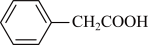
 (
( )
)
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

步骤一:将a中所加的硫酸溶液加热至100℃,缓缓滴入40.0g苯乙腈,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品并进行提纯。
步骤二:用
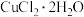 和
和 溶液制备适量
溶液制备适量 沉淀,并用蒸馏水多次洗涤沉淀。
沉淀,并用蒸馏水多次洗涤沉淀。步骤三:将苯乙酸加入乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度 |
| 苯乙腈 | 117 | -48 | 197 | 微溶于冷水,易溶于乙醇 | 1.08 |
| 苯乙酸 | 136 | 76.5 | 161 | 微溶于冷水,易溶于乙醇 | 1.17 |
(1)仪器a的名称是
(2)制备苯乙酸时,最合适的加热方法是
(3)步骤一中加适量冷水的目的是
(4)提纯粗苯乙酸的方法是
您最近一年使用:0次
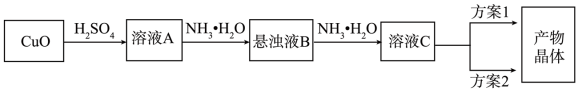
3 . 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
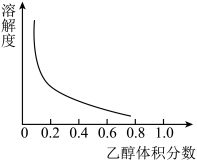
请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是_____ 。
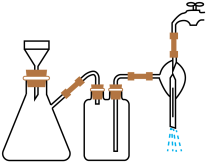
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有_____ 杂质,产生该杂质的原因是______ 。
(2)方案2的实验步骤为:a.向溶液C中加入适量____ ,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________ 。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:____________ 。
③步骤d采用________ 干燥的方法。

相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+
 Cu2++4NH3
Cu2++4NH3②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图

请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是

A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有
(2)方案2的实验步骤为:a.向溶液C中加入适量
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:
③步骤d采用
您最近一年使用:0次
2019-06-29更新
|
362次组卷
|
2卷引用:2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业
2024高三下·全国·专题练习
解题方法
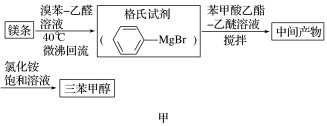
4 . 三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。

已知:①格氏试剂容易水解: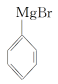 +H2O→
+H2O→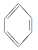 +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)
②相关物质的物理性质如下:
③三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
请回答以下问题:
(1)图乙中玻璃仪器B的名称为___________ ;装有无水CaCl2的仪器A的作用是___________ 。
(2)图乙中滴加液体未用普通分液漏斗而用滴液漏斗的作用是___________ ;
制取格氏试剂时要保持微沸,可以采用___________ 加热方式。
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:

其中,操作Ⅰ为___________ ;洗涤液最好选用___________ (填字母);
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为___________ 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为___________ 。
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。

已知:①格氏试剂容易水解:
 +H2O→
+H2O→ +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)②相关物质的物理性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 三苯甲醇 | 164.2 | 380 | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3 | 34.6 | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7 | 156.2 | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6 | 212.6 | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
请回答以下问题:
(1)图乙中玻璃仪器B的名称为
(2)图乙中滴加液体未用普通分液漏斗而用滴液漏斗的作用是
制取格氏试剂时要保持微沸,可以采用
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:

其中,操作Ⅰ为
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为
您最近一年使用:0次
名校
5 . 工业上利用焦炭和水蒸气发生如下的两个反应:①C(s)+H2O(g) CO(g)+H2(g)、②CO(g)+H2O(g)
CO(g)+H2(g)、②CO(g)+H2O(g) CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
 CO(g)+H2(g)、②CO(g)+H2O(g)
CO(g)+H2(g)、②CO(g)+H2O(g) CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是A.制备NH3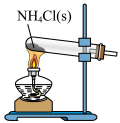 | B.干燥NH3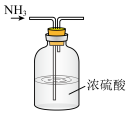 |
C.收集NH3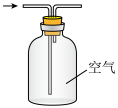 | D.吸收多余的NH3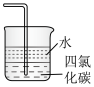 |
您最近一年使用:0次
2024-02-23更新
|
765次组卷
|
4卷引用:河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期3月月考化学试题
河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期3月月考化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题江苏省无锡市第一中学2023-2024学年高三上学期10月份质量检测化学试题
名校
解题方法
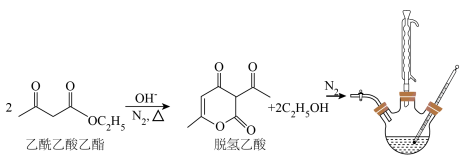
6 . 脱氢乙酸是一种重要的有机合成中间体和低毒高效食品防腐剂,实验室以乙酰乙酸乙酯为原料,在OH-的催化作用下制备脱氢乙酸的反应原理和实验装置如图(夹持和加热装置已省略):
Ⅰ.脱氢乙酸的合成
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
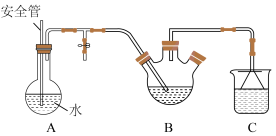
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是___________ 。
(2)步骤Ⅰ中②过程中不需要用到的仪器为___________ (填字母)。___________ ℃、___________ h、___________ 作催化剂。与其他催化剂相比,所选催化剂使脱氢乙酸产率最高的原因可能为___________ 。___________ ,漏斗的作用为___________ 。
(5)脱氢乙酸的产率约为___________(填字母)。
| 名称 | 相对分子质量 | 性状 | 密度/ | 熔点/℃ | 沸点/℃ | 物理性质 |
| 乙酰乙酸乙酯 | 130 | 无色透明液体 | 1.03 | -39 | 180.8 | 微溶于水,易溶于乙醇等有机溶剂 |
| 脱氢乙酸 | 168 | 白色晶体 | — | 109~111 | 269.9 | 微溶于乙醇和冷水,具有较强的还原性 |
| 乙醇 | 46 | 无色透明液体 | 0.79 | -114.1 | 78.3 | 与水任意比例互溶,易溶于有机溶剂 |
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是
(2)步骤Ⅰ中②过程中不需要用到的仪器为


(5)脱氢乙酸的产率约为___________(填字母)。
| A.54% | B.64% | C.74% | D.84% |
您最近一年使用:0次
2024-04-02更新
|
523次组卷
|
5卷引用:黑龙江省哈尔滨市三校联考2024届高三二模化学试题
黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)东北三省2024届高三下学期三校二模联考化学试题2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
2023·福建厦门·三模
名校
7 . 在无水三氯化铝的催化作用下,利用乙醇制备乙烯的反应温度是 。某兴趣小组据此设计如下图所示实验,合成无水
。某兴趣小组据此设计如下图所示实验,合成无水 并完成乙烯的制备及收集。
并完成乙烯的制备及收集。
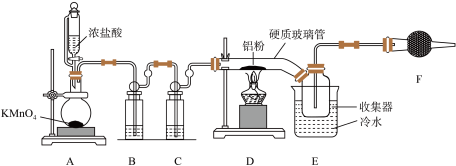
Ⅰ.无水 的制备
的制备
(1) 中盛装浓盐酸的仪器名称为
中盛装浓盐酸的仪器名称为___________ 。
(2)装置 中发生的化学方程式为
中发生的化学方程式为___________ 。
(3)硬质玻璃管直接接入收集器的优点是___________ 。
(4)装置F中的药品名称是___________ 。
Ⅱ.乙烯的制备及收集
实验过程:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL无水乙醇,点燃酒精灯加热。

(5)该催化机理如下图所示,写出此反应历程中生成 的反应方程式
的反应方程式___________ 。
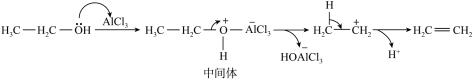
(6)实验装置中还缺少的仪器是___________ 。加入药品后,开始实验前,应先打开止水夹___________ (填“1”、“2”或“1”和“2”),反应进行一段时间后,出现现象___________ ,再关闭相应止水夹。
(7)B中无水氯化钙的作用是___________ 。
(8)与教材中用乙醇和浓硫酸制备乙烯相比,用三氯化铝做催化剂制备乙烯的优点有___________ (任写两点)。
 。某兴趣小组据此设计如下图所示实验,合成无水
。某兴趣小组据此设计如下图所示实验,合成无水 并完成乙烯的制备及收集。
并完成乙烯的制备及收集。
Ⅰ.无水
 的制备
的制备(1)
 中盛装浓盐酸的仪器名称为
中盛装浓盐酸的仪器名称为(2)装置
 中发生的化学方程式为
中发生的化学方程式为(3)硬质玻璃管直接接入收集器的优点是
(4)装置F中的药品名称是
Ⅱ.乙烯的制备及收集
实验过程:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL无水乙醇,点燃酒精灯加热。

(5)该催化机理如下图所示,写出此反应历程中生成
 的反应方程式
的反应方程式
(6)实验装置中还缺少的仪器是
(7)B中无水氯化钙的作用是
(8)与教材中用乙醇和浓硫酸制备乙烯相比,用三氯化铝做催化剂制备乙烯的优点有
您最近一年使用:0次
8 . 溴化苄是重要的有机合成工业原料,可以苯甲醇为原料合成,实验原理及装置如图所示。反应结束后,反应液可按下列步骤分离和纯化:静置→分液→水洗→纯碱洗→水洗→干燥→减压蒸馏。下列有关说法错误的是
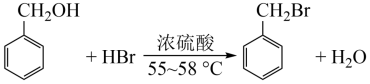



| A.实验时,应先从冷凝管接口b处通水,后加热至反应温度 |
| B.该实验适宜用水浴加热 |
| C.浓硫酸作催化剂和脱水剂 |
| D.纯碱洗的目的是除去氢溴酸等酸性物质 |
您最近一年使用:0次
2021高三·全国·专题练习
9 . 氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应,并产生同一种气体。回答下列问题:
Ⅰ.制备氢化锂(LiH):
选择图中的装置制备氢化锂(必要时可重复使用)。

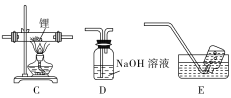
(1)装置D中NaOH溶液的作用是_______ 。
(2)装置的连接顺序(从左至右)为A→_______ 。
Ⅱ.制备氢化铝锂:1947年,Schlesinger、Bond 和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)将乙醚换为水是否可行,请简述理由:_______ 。
(4)氢化锂与无水三氯化铝反应的化学方程式为_______ 。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度。
(5)按图装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是_______ 。读数之前,上下移动量气管在右侧的容器,使量气管左、右两侧的液面在同一水平面上,其目的是_______ 。

(6)标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_______ (用含a、V1、V2的代数式表示)。若起始读数时俯视刻度线,测得的结果将_______ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备氢化锂(LiH):
选择图中的装置制备氢化锂(必要时可重复使用)。


(1)装置D中NaOH溶液的作用是
(2)装置的连接顺序(从左至右)为A→
Ⅱ.制备氢化铝锂:1947年,Schlesinger、Bond 和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)将乙醚换为水是否可行,请简述理由:
(4)氢化锂与无水三氯化铝反应的化学方程式为
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度。
(5)按图装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是

(6)标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为
您最近一年使用:0次
10 . 氰化氢( )和乙腈(
)和乙腈(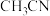 )作为重要的化工原料,在合成医药和精细化学品等领域有广泛用途。实验室中制备氰化氢和乙腈的装置如图甲所示。回答下列问题:
)作为重要的化工原料,在合成医药和精细化学品等领域有广泛用途。实验室中制备氰化氢和乙腈的装置如图甲所示。回答下列问题:

(1)甲烷和氨气反应生成 和一种单质气体的化学方程式为
和一种单质气体的化学方程式为_______ 。
(2)实验室中制备 和
和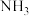 的反应原理分别为
的反应原理分别为
制备 :
:
制备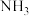 (以浓氨水和生石灰为原料):
(以浓氨水和生石灰为原料):_______ 。
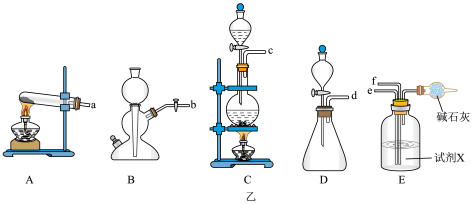
图乙所示分别为制备 和
和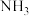 并得到合适体积比混合气体的装置,根据上述原理选择合适的仪器并连接成装置,则连接顺序为a→e,
并得到合适体积比混合气体的装置,根据上述原理选择合适的仪器并连接成装置,则连接顺序为a→e,_______ →f(填接口标号)。装置E中的试剂X为_______ (填“饱和食盐水”“浓硫酸”或“四氯化碳”)。装置E相当于图甲装置中的_______ 。
 )和乙腈(
)和乙腈(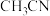 )作为重要的化工原料,在合成医药和精细化学品等领域有广泛用途。实验室中制备氰化氢和乙腈的装置如图甲所示。回答下列问题:
)作为重要的化工原料,在合成医药和精细化学品等领域有广泛用途。实验室中制备氰化氢和乙腈的装置如图甲所示。回答下列问题:
(1)甲烷和氨气反应生成
 和一种单质气体的化学方程式为
和一种单质气体的化学方程式为(2)实验室中制备
 和
和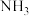 的反应原理分别为
的反应原理分别为制备
 :
:
制备
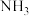 (以浓氨水和生石灰为原料):
(以浓氨水和生石灰为原料):图乙所示分别为制备
 和
和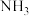 并得到合适体积比混合气体的装置,根据上述原理选择合适的仪器并连接成装置,则连接顺序为a→e,
并得到合适体积比混合气体的装置,根据上述原理选择合适的仪器并连接成装置,则连接顺序为a→e,
您最近一年使用:0次



