1 . 次氯酸锂稳定性远高于次氯酸钠,也可用于杀菌消毒。制备次氯酸锂方法较多,常用的一种合成路线如图:

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是________ ;②浓盐酸逐滴滴加而不是一次性加入的原因是__________ 。
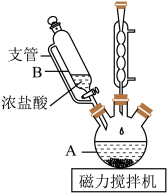
(2)请写出在装置A中发生反应的化学方程式______________ 。
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因___________ 。
(4)该实验中次氯酸锂的产率为_________ 。

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是

(2)请写出在装置A中发生反应的化学方程式
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因
(4)该实验中次氯酸锂的产率为
您最近一年使用:0次
2019-09-09更新
|
107次组卷
|
2卷引用:四川省射洪县射洪中学2020届高三补习班上学期入学考试化学试题
名校
2 . 氨基甲酸铵(NH2COONH4)是一种重要的医用氨化剂,有关该物质的信息如下表所示:
某实验小组在实验室中利用下列装置合成少量的氨基甲酸铵。回答下列问题:
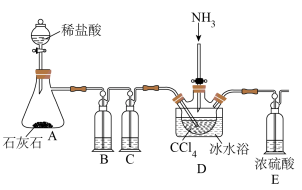
(1)盛放稀盐酸的仪器的名称是___________ 。
(2)装置B和C中试剂的名称分别是___________ 、___________ 。
(3)实验室制取氨气的化学方程式为___________ 。
(4)反应结束后,从三颈烧瓶中分离出产品,进行的实验操作是___________ 。
(5)装置E的作用有___________ (写出两点)。若观察到E中出现大量气泡(浓硫酸足量),则可能的原因是___________ 。
(6)设计实验:检验制得的产品中是否混有 ?
?___________ 。
| 制备原理 | 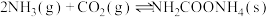 放热反应 放热反应 |
| 主要性质 | ①在潮湿的空气中转变为 ②温度较高时容易分解生成  、 、 ③不溶于  |

(1)盛放稀盐酸的仪器的名称是
(2)装置B和C中试剂的名称分别是
(3)实验室制取氨气的化学方程式为
(4)反应结束后,从三颈烧瓶中分离出产品,进行的实验操作是
(5)装置E的作用有
(6)设计实验:检验制得的产品中是否混有
 ?
?
您最近一年使用:0次
2023-07-14更新
|
77次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期开学化学试题
名校
解题方法
3 . 某科研小组制备了新型锂离子电池电极材料-ZnLix/Li3N。科研小组以废旧锌锰电池的锌皮为原料合成该电极材料,简易流程如下:

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
回答下列问题:
(1)提高“酸浸”速率的措施有_____ (答一条即可),“调pH”的范围为_____ 。
(2)“沉锌”的离子方程式为_____ 。
(3)系列操作包括的操作步骤有_____ 、过滤、洗涤、干燥
(4)SOCl2的作用是_____ (用化学方程式表示)。
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
如果氧化剂X选择硝酸,其后果是_____ 和会产生大气污染物。从下列物质中选择氧化剂X,杂质除去率最高的是_____ (填标号)。
A.NaClO B.Cl2 C.O2 D.O3
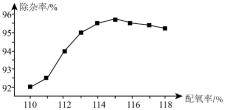
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:_____ 。

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 2.2 | 7.5 | 8.0 | 6.5 |
| 完全沉淀的pH | 3.5 | 9.5 | 10.8 | 8.5 |
(1)提高“酸浸”速率的措施有
(2)“沉锌”的离子方程式为
(3)系列操作包括的操作步骤有
(4)SOCl2的作用是
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
| 物质 | HClO/Cl- | Cl2/Cl- | O2/H2O | O3/O2 | HNO3/NO | Fe3+/Fe2+ | MnO2/Mn2+ |
| φ0 | 1.482 | 1.358 | 1.229 | 2.076 | 0.983 | 0.771 | 1.224 |
A.NaClO B.Cl2 C.O2 D.O3
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:

您最近一年使用:0次
4 . 环己酮可作为涂料和油漆的溶剂。在实验室中以环己醇为原料制备环己酮。

已知:环己醇、环己酮、醋酸的部分物理性质如下表:
回答下列问题:
(1)B装置的名称是_______ 。
(2)酸化NaClO时不能选用盐酸,原因是_______ (用离子方程式表示)。
(3)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在30~35℃范围内,可采取的措施一是加热方式选用_______ ,二是在加入反应物时将_______ (填化学式)缓慢滴加到其它试剂中。
(4)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮、水和_______ (填写化学式)的混合物。
(5)环己酮的提纯过程为:
①在馏分中加NaCl固体至饱和,静置,分液;加NaCl的目的是_______ 。
②加入无水MgSO4块状固体;目的是_______ 。
③_______ (填操作名称)后进行蒸馏,收集150~155℃的馏分。
(6)数据处理。反应开始时加入8.4mL(0.08mol)环己醇,20mL冰醋酸和过量的NaClO溶液。实验结束后收集到产品0.06mol,则该合成反应的产率为_______ 。合成产品中主要杂质有_______ 。

已知:环己醇、环己酮、醋酸的部分物理性质如下表:
| 物质 | 沸(熔)点/(℃,1atm) | 密度/(g/cm3) | 溶解性 |
| 环己醇 | 161.1(-21) | 0.96 | 能溶于水,易溶于常见有机溶剂 |
| 环己酮 | 155.6(-47) | 0.94 | 微溶于水 |
| 醋酸 | 118(16.6) | 1.05 | 易溶于水 |
(1)B装置的名称是
(2)酸化NaClO时不能选用盐酸,原因是
(3)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在30~35℃范围内,可采取的措施一是加热方式选用
(4)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮、水和
(5)环己酮的提纯过程为:
①在馏分中加NaCl固体至饱和,静置,分液;加NaCl的目的是
②加入无水MgSO4块状固体;目的是
③
(6)数据处理。反应开始时加入8.4mL(0.08mol)环己醇,20mL冰醋酸和过量的NaClO溶液。实验结束后收集到产品0.06mol,则该合成反应的产率为
您最近一年使用:0次
5 . 硫脲[ CS( NH2)2 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,也可用作橡胶的硫化促进剂以及金属矿物的浮选剂等,是一种白色晶体熔点180°C,易溶于水和乙醇,受热时部分发生异构化反应而生成硫氰化铵。回答下列问题:
I.硫脲的制备:
已知:将石灰氮(CaCN2)和水的混合物加热至80°C时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示。
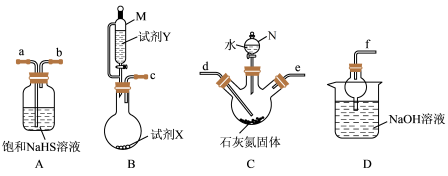
(1)装置B中的试剂X和试剂Y的组合可选用_______ ( 填标号)。
A.FeS固体+稀盐酸 B.FeS固体+稀硝酸 C.FeS固体+稀硫酸
(2)仪器N的名称是_______ ;在注液时,仪器M与仪器N相比使用的优点是_______ 。
(3)按气流从左到右的方向,上述装置的接口连接顺序为c→_____ (填写仪器接口的小写字母)
(4)装置C中发生反应的化学方程式为_______ ; 反应温度需控制在80℃ ,温度不宜过高或过低的原因是_______ 。
II.硫脲的分离及产品含量的测定:
(5)装置C反应后的液体过滤后,进行减压蒸发浓缩、冷却结晶、离心分离,最后烘干获得产品。称取mg产品,加水溶解配成500mL溶液,量取50mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用c mol·L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液V mL。
①滴定时,硫脲发生反应的离子方程式为:_____[CS(NH2)2] + 14 +______H+=14Mn2++______CO2 +_____N2+____
+______H+=14Mn2++______CO2 +_____N2+____  + 26H2O,请配平并补全离子方程式的系数
+ 26H2O,请配平并补全离子方程式的系数_______ 。
②滴定至终点时的现象是_______ 。
③样品中硫脲的质量分数为_______ (用含“m、c、V”的最简式表示)。
I.硫脲的制备:
已知:将石灰氮(CaCN2)和水的混合物加热至80°C时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示。

(1)装置B中的试剂X和试剂Y的组合可选用
A.FeS固体+稀盐酸 B.FeS固体+稀硝酸 C.FeS固体+稀硫酸
(2)仪器N的名称是
(3)按气流从左到右的方向,上述装置的接口连接顺序为c→
(4)装置C中发生反应的化学方程式为
II.硫脲的分离及产品含量的测定:
(5)装置C反应后的液体过滤后,进行减压蒸发浓缩、冷却结晶、离心分离,最后烘干获得产品。称取mg产品,加水溶解配成500mL溶液,量取50mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用c mol·L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液V mL。
①滴定时,硫脲发生反应的离子方程式为:_____[CS(NH2)2] + 14
 +______H+=14Mn2++______CO2 +_____N2+____
+______H+=14Mn2++______CO2 +_____N2+____  + 26H2O,请配平并补全离子方程式的系数
+ 26H2O,请配平并补全离子方程式的系数②滴定至终点时的现象是
③样品中硫脲的质量分数为
您最近一年使用:0次
2023-03-10更新
|
224次组卷
|
3卷引用:四川省成都市石室天府中学2024届高三一诊模拟(二)理综-化学试题
四川省成都市石室天府中学2024届高三一诊模拟(二)理综-化学试题内蒙古包头市2022-2023学年高三上学期期末教学质量检测理综化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(实验综合题)
名校
6 . 以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:_________ 。
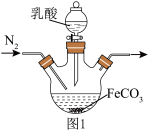
(2)向溶液1中加入过量铁粉的目的是_____________ 。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是___________ 。
(4)实验室制备乳酸亚铁的装置如图1所示。________ 。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是______________ 。
(5)已知:①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
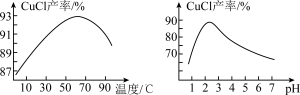
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图2、3所示。______ 。
(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。

(2)向溶液1中加入过量铁粉的目的是
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是
(4)实验室制备乳酸亚铁的装置如图1所示。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是
(5)已知:①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图2、3所示。
(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
您最近一年使用:0次
2019-03-28更新
|
703次组卷
|
5卷引用:四川省泸县第四中学2019-2020学年高一下学期第二次月考化学试题



