名校
1 . 苯乙酸铜是合成优良催化剂、传感材料—纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:
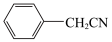
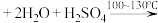
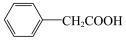

2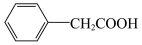
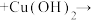 (
(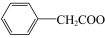 )
)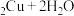
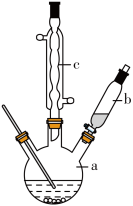
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是___________ ,其作用是___________ 。
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是___________ 。
(3)分离苯乙酸粗品的方法是___________ ,提纯粗苯乙酸的方法是___________ 。最终得到44g纯品,则苯乙酸的产率是___________ (保留两位有效数字)。
(4)用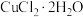 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________ 。

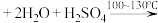

2
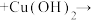 (
( )
)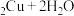
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
(3)分离苯乙酸粗品的方法是
(4)用
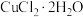 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2023-04-30更新
|
206次组卷
|
4卷引用:云南省曲靖市民族中学2022-2023学年高二下学期期中考试化学试题
2 . (1)龚老师在大学时候以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为_____ ;实验中控制温度除用冰水浴外,还需采取的措施是_______ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图所示。

NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_________ ;使用冷凝管的目的是_____ 。
(3)紧接着龚老师查阅资料发现AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了下图实验装置并进行下列实验。

先断开电键K,向溶液X中滴加0.1mol·L-1KSCN溶液,无明显现象,说明___________________ ;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____ ,溶液变红的原因是__________________ (用离子方程式表示),该实验设计的优点是_____ 。

已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图所示。

NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是
(3)紧接着龚老师查阅资料发现AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了下图实验装置并进行下列实验。

先断开电键K,向溶液X中滴加0.1mol·L-1KSCN溶液,无明显现象,说明
您最近一年使用:0次
名校
解题方法
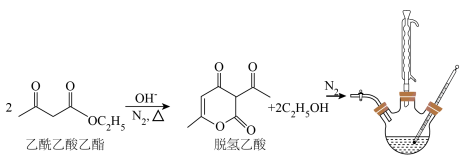
3 . 脱氢乙酸是一种重要的有机合成中间体和低毒高效食品防腐剂,实验室以乙酰乙酸乙酯为原料,在OH-的催化作用下制备脱氢乙酸的反应原理和实验装置如图(夹持和加热装置已省略):
Ⅰ.脱氢乙酸的合成
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是___________ 。
(2)步骤Ⅰ中②过程中不需要用到的仪器为___________ (填字母)。___________ ℃、___________ h、___________ 作催化剂。与其他催化剂相比,所选催化剂使脱氢乙酸产率最高的原因可能为___________ 。___________ ,漏斗的作用为___________ 。
(5)脱氢乙酸的产率约为___________(填字母)。
| 名称 | 相对分子质量 | 性状 | 密度/ | 熔点/℃ | 沸点/℃ | 物理性质 |
| 乙酰乙酸乙酯 | 130 | 无色透明液体 | 1.03 | -39 | 180.8 | 微溶于水,易溶于乙醇等有机溶剂 |
| 脱氢乙酸 | 168 | 白色晶体 | — | 109~111 | 269.9 | 微溶于乙醇和冷水,具有较强的还原性 |
| 乙醇 | 46 | 无色透明液体 | 0.79 | -114.1 | 78.3 | 与水任意比例互溶,易溶于有机溶剂 |
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
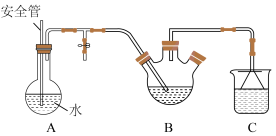
(1)步骤Ⅰ中通入N2的目的是
(2)步骤Ⅰ中②过程中不需要用到的仪器为


(5)脱氢乙酸的产率约为___________(填字母)。
| A.54% | B.64% | C.74% | D.84% |
您最近一年使用:0次
2024-04-02更新
|
566次组卷
|
5卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学东北三省2024届高三下学期三校二模联考化学试题黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
4 . 2-硝基-1,3-苯二酚是重要的医药中间体。实验室常以间苯二酚为原料,经磺化、硝化、去磺酸基三步合成:

部分物质相关性质如下表:
制备过程如下:
第一步:磺化——称取11g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内搅拌15min(如图1)。

第二步:硝化——待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15min。
第三步:蒸馏——将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用如图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的),收集馏出物,得到2-硝基-1,3-苯二酚粗品。

请回答下列问题:
(1)图1中仪器b的名称是:___________ ;磺化步骤中控制温度最合适的范围为___________ (填字母代号,下同)。
A.30~60℃ B.60~65℃ C.65~70℃ D.70~100℃
(2)已知:酚羟基邻对位的氢原子比较活泼,均易被取代。请分析第一步磺化引入磺酸基基团( )的作用是
)的作用是___________ 。
(3)硝化步骤中制取“混酸”的具体操作是___________ 。
(4)水蒸气蒸馏是分离和提纯有机物的方法之一,对于被提纯物质必须具备的条件,下列说法错误的是___________。
(5)下列说法正确的是___________。
(6)7本实验最终获得3.1g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为___________ (保留3位有效数字)。

部分物质相关性质如下表:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
| 2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
第一步:磺化——称取11g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内搅拌15min(如图1)。

第二步:硝化——待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15min。
第三步:蒸馏——将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用如图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的),收集馏出物,得到2-硝基-1,3-苯二酚粗品。

请回答下列问题:
(1)图1中仪器b的名称是:
A.30~60℃ B.60~65℃ C.65~70℃ D.70~100℃
(2)已知:酚羟基邻对位的氢原子比较活泼,均易被取代。请分析第一步磺化引入磺酸基基团(
 )的作用是
)的作用是(3)硝化步骤中制取“混酸”的具体操作是
(4)水蒸气蒸馏是分离和提纯有机物的方法之一,对于被提纯物质必须具备的条件,下列说法错误的是___________。
| A.不溶或难溶于水,便于最后分离 | B.难挥发性 |
| C.能随水蒸气蒸馏而不被破坏 | D.在水中稳定 |
| A.反应一段时间后,停止蒸馏,先熄灭酒精灯,再打开旋塞,最后停止通冷凝水 |
| B.直型冷凝管内壁中可能会有红色晶体析出 |
| C.烧瓶a中长玻璃管与外界空气相通,能使装置中压强趋于稳定 |
| D.为了达到更好的冷凝效果,应用图1中b装置替换图2中C装置 |
您最近一年使用:0次
2023-06-27更新
|
420次组卷
|
2卷引用:云南省部分名校2022-2023学年高二下学期6月联考化学试题
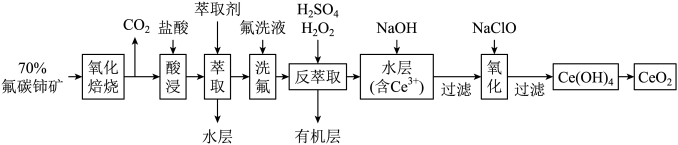
5 . 二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
已知:
①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是___ 。
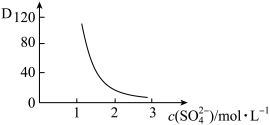
(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•H2n-4A2n+4H+。实验室中萃取时用到的主要玻璃仪器名称为___ ;如图中D是分配比,表示Ce4+分别在有机层中与水层中存在形式的物质的量浓度之比 。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:
。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:___ 。
(3)“反萃取”中,在稀硫酸和H2O2的作用下Ce4+转化为Ce3+,H2O2在该反应中的作用是___ (填“催化剂”“氧化剂”或“还原剂”)。
(4)“氧化”步骤的化学方程式为___ 。
(5)取上述流程中得到的CeO2产品0.43g,加硫酸溶解后,用0.1mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为___ 。

已知:
①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•H2n-4A2n+4H+。实验室中萃取时用到的主要玻璃仪器名称为
 。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:
。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:
(3)“反萃取”中,在稀硫酸和H2O2的作用下Ce4+转化为Ce3+,H2O2在该反应中的作用是
(4)“氧化”步骤的化学方程式为
(5)取上述流程中得到的CeO2产品0.43g,加硫酸溶解后,用0.1mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为
您最近一年使用:0次
6 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
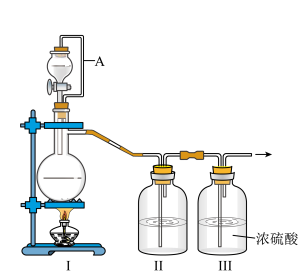
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________ 。
③装置Ⅶ的作用是________________________________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净的Cl2 | MnO2 | ① | ② |
| 制备纯净的NO | Cu | ③ | ④ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
2017-03-07更新
|
4680次组卷
|
18卷引用:云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题
云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题福建省莆田第六中学2018届高三上学期期中考试化学试题河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题湖北省荆州中学2018届高三4月月考理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升高一必修第二册(人教2019版)第五章 素养检测山东省枣庄市2021届高三上学期第三次质量检测化学试题山西省晋城市陵川县高级实验中学2020-2021学年高一下学期3月月考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验



