云南省楚雄彝族自治州禄丰县第三中学2019-2020学年高三上学期期末考试理综化学试题
云南
高三
期末
2020-03-03
279次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、有机化学基础、化学实验基础、认识化学科学、物质结构与性质
云南省楚雄彝族自治州禄丰县第三中学2019-2020学年高三上学期期末考试理综化学试题
云南
高三
期末
2020-03-03
279次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、有机化学基础、化学实验基础、认识化学科学、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 化学与科技、生产、生活密切相关,下列说法正确的是( )
| A.使用含有CaCl2的融雪剂会加速对桥梁的腐蚀 |
| B.二氧化氯(ClO2)具有还原性,故可用作自来水的杀菌消毒 |
| C.碳酸氢钠(NaHCO3)是一种抗酸药,服用时喝些醋能提高药效 |
| D.“华为麒麟980”手机中芯片的主要成分是二氧化硅 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 实验室制备硝基苯的实验装置如图所示,关于实验操作或叙述错误的是


| A.配制一定比例的浓H2SO4和浓HNO3混合酸时是往浓HNO3注入浓H2SO4,并及时搅拌和冷却 |
| B.在50~60℃下发生反应,图中加热方式是水浴加热 |
| C.实验中长导管能除了导气外还起冷凝回流的作用 |
| D.反应后的混合液经稀碱溶液洗涤、结晶,得到硝基苯 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
3. 有机物W在工业上常用作溶剂和香料,其合成方法如图,下列说法不正确的是
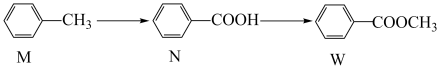

| A.M、N、W均能发生加成反应和取代反应 |
| B.N、W组成上相差一个CH2原子团,所以互为同系物 |
| C.1molM与1molw完全燃烧消耗O2的物质的量相同 |
| D.M苯环上的二氯代物有6种 |
您最近一年使用:0次
2019-04-18更新
|
824次组卷
|
5卷引用:【市级联考】陕西省榆林市2019届高三下学期高考模拟第三次测试理科综合化学试题
单选题
|
适中(0.65)
解题方法
4. 在下列各溶液中,一定能大量共存的离子组是( )
| A.常温下水电离的c(H+)为1×10-12mol/L的溶液中:I-、Na+、Cl-、NO3- |
| B.滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3- |
| C.无色透明的溶液中:MnO4-、K+、H+、SO42- |
| D.弱碱性溶液中:Na+、K+、Cl-、CO32- |
【知识点】 离子反应的发生条件解读 限定条件下的离子共存解读
您最近一年使用:0次
单选题
|
适中(0.65)
5. 用NA表示阿伏加 德罗常数的数值。下列说法正确的是( )
| A.0.1mol⋅L-1的AlCl3溶液中含Al3+的数目小于0.1NA |
| B.0.5mol环己烷中含非极性键的数目为2.5NA |
| C.30g由葡萄糖和乳酸(C3H6O3)组成的混合物中含氢原子数目为2NA |
| D.7.1gCl2完全反应转移的电子数一定为0.2NA |
您最近一年使用:0次
单选题
|
较易(0.85)
6. 关于小苏打溶液的表述错误的是
| A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.HCO3-的电离程度小于其水解程度 |
| D.c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
您最近一年使用:0次
2017-05-24更新
|
453次组卷
|
3卷引用:安徽省江南十校2017届高三5月冲刺联考(二模)理综化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家,磷酸铁锂锂离子电池充电时阳极反应式为, ,电池放电时,锂离子从石墨晶体中脱嵌出来,通过隔膜迁移到磷酸铁锂晶体表面,然后重新嵌入到磷酸铁锂的晶格内,放电工作示意图如图。下列叙述不正确的是
,电池放电时,锂离子从石墨晶体中脱嵌出来,通过隔膜迁移到磷酸铁锂晶体表面,然后重新嵌入到磷酸铁锂的晶格内,放电工作示意图如图。下列叙述不正确的是
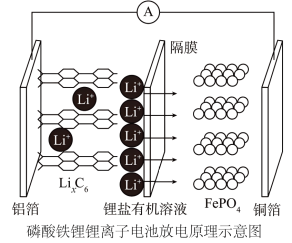
 ,电池放电时,锂离子从石墨晶体中脱嵌出来,通过隔膜迁移到磷酸铁锂晶体表面,然后重新嵌入到磷酸铁锂的晶格内,放电工作示意图如图。下列叙述不正确的是
,电池放电时,锂离子从石墨晶体中脱嵌出来,通过隔膜迁移到磷酸铁锂晶体表面,然后重新嵌入到磷酸铁锂的晶格内,放电工作示意图如图。下列叙述不正确的是
| A.放电时,Li+通过隔膜移向正极 |
| B.放电时,电子由铝箔沿导线流向铜箔 |
C.放电时正极反应为: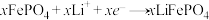 |
| D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不变 |
您最近一年使用:0次
2020-10-05更新
|
1091次组卷
|
14卷引用:北京市朝阳区2019~2020学年高三上学期期中考试化学试题
北京市朝阳区2019~2020学年高三上学期期中考试化学试题湖南省长沙市雅礼中学2019-2020学年高二上学期第三次月考化学试题2019年四川省南充市高考第一次高考适应性考试理综化学试题湖南省雅礼中学2019-2020学年高二上学期第二次月考化学试题山东省泰安市2020届高三上学期期末考试化学试题备考突破2020高三化学专题强化集训——原电池的理解和应用重庆市西南大学附属中学2020届高三第五次月考理综化学试题云南省楚雄彝族自治州禄丰县第三中学2019-2020学年高三上学期期末考试理综化学试题山东省莱芜一中2020届高三3月份开学考试化学试题江苏省海安高级中学2020届高三模拟考试化学试题江苏省海安高级中学2020届高三调研考试化学试题卓越联盟新高考省份2021届高三9月份检测化学试题辽宁省新高考2021届高三上学期第三次调研化学试题北京市昌平区新学道临川学校2020届高三上学期期末考试化学试题
二、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
名校
解题方法
8. 贮氢合金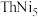 可催化由CO、
可催化由CO、 合成
合成 等有机化工产品的反应。温度为TK时发生以下反应:
等有机化工产品的反应。温度为TK时发生以下反应:
①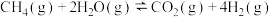
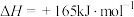
②
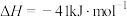
③
④
(1)温度为TK时,催化由CO、 合成
合成 反应的热化学方程式为
反应的热化学方程式为________ 。
(2)已知温度为TK时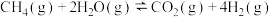 的活化能为
的活化能为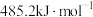 ,则其逆反应的活化能为
,则其逆反应的活化能为________  。
。
(3)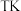 时,向一恒压密闭容器中充入等物质的量的
时,向一恒压密闭容器中充入等物质的量的 和
和 发生上述反应②
发生上述反应② 已排除其他反应干扰
已排除其他反应干扰 ,测得
,测得 物质的量分数随时间变化如下表所示:
物质的量分数随时间变化如下表所示:
若初始投入CO为 ,恒压容器容积
,恒压容器容积 ,用
,用 表示该反应
表示该反应 分钟内的速率
分钟内的速率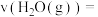
________ 。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为________ 。
(4)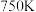 下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为
下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为 ,达到平衡转化率为
,达到平衡转化率为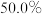 ,则反应的平衡常数
,则反应的平衡常数
________  用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数,忽略其它反应
物质的量分数,忽略其它反应 。
。
(5)某温度下,将 与
与 的混合气体充入容积为
的混合气体充入容积为 的密闭容器中,在催化剂的作用下发生反应③。经过
的密闭容器中,在催化剂的作用下发生反应③。经过 后,反应达到平衡,此时转移电子
后,反应达到平衡,此时转移电子 。若保持体积不变,再充入
。若保持体积不变,再充入 和
和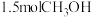 ,此时
,此时
________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。下列不能说明该反应已达到平衡状态的是
。下列不能说明该反应已达到平衡状态的是________ 。
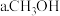 的质量不变
的质量不变  混合气体的平均相对分子质量不再改变
混合气体的平均相对分子质量不再改变
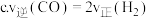
 混合气体的密度不再发生改变
混合气体的密度不再发生改变
(6)已知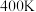 、
、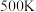 时水煤气变换中CO和
时水煤气变换中CO和 分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的
分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的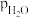 和
和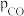 相等、
相等、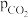 和
和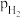 相等;已知
相等;已知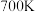 时
时 的
的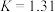 。
。

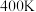 时
时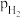 随时间变化关系的曲线是
随时间变化关系的曲线是________ ,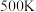 时
时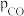 随时间变化关系的曲线是
随时间变化关系的曲线是________ 。
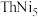 可催化由CO、
可催化由CO、 合成
合成 等有机化工产品的反应。温度为TK时发生以下反应:
等有机化工产品的反应。温度为TK时发生以下反应:①
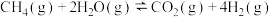
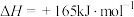
②

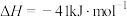
③

④

(1)温度为TK时,催化由CO、
 合成
合成 反应的热化学方程式为
反应的热化学方程式为(2)已知温度为TK时
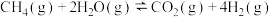 的活化能为
的活化能为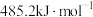 ,则其逆反应的活化能为
,则其逆反应的活化能为 。
。(3)
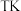 时,向一恒压密闭容器中充入等物质的量的
时,向一恒压密闭容器中充入等物质的量的 和
和 发生上述反应②
发生上述反应② 已排除其他反应干扰
已排除其他反应干扰 ,测得
,测得 物质的量分数随时间变化如下表所示:
物质的量分数随时间变化如下表所示:时间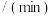 | 0 | 2 | 5 | 6 | 9 | 10 |
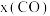 | 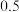 |  |  |  |  |  |
 ,恒压容器容积
,恒压容器容积 ,用
,用 表示该反应
表示该反应 分钟内的速率
分钟内的速率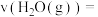
(4)
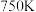 下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为
下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为 ,达到平衡转化率为
,达到平衡转化率为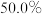 ,则反应的平衡常数
,则反应的平衡常数
 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数,忽略其它反应
物质的量分数,忽略其它反应 。
。(5)某温度下,将
 与
与 的混合气体充入容积为
的混合气体充入容积为 的密闭容器中,在催化剂的作用下发生反应③。经过
的密闭容器中,在催化剂的作用下发生反应③。经过 后,反应达到平衡,此时转移电子
后,反应达到平衡,此时转移电子 。若保持体积不变,再充入
。若保持体积不变,再充入 和
和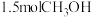 ,此时
,此时
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。下列不能说明该反应已达到平衡状态的是
。下列不能说明该反应已达到平衡状态的是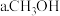 的质量不变
的质量不变  混合气体的平均相对分子质量不再改变
混合气体的平均相对分子质量不再改变
 混合气体的密度不再发生改变
混合气体的密度不再发生改变(6)已知
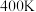 、
、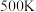 时水煤气变换中CO和
时水煤气变换中CO和 分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的
分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的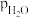 和
和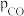 相等、
相等、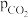 和
和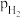 相等;已知
相等;已知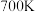 时
时 的
的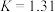 。
。
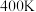 时
时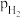 随时间变化关系的曲线是
随时间变化关系的曲线是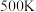 时
时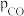 随时间变化关系的曲线是
随时间变化关系的曲线是
您最近一年使用:0次
2020-02-26更新
|
323次组卷
|
4卷引用:2019年安徽省蚌埠市高三第二次教学质量检查考试理综化学试题
三、填空题 添加题型下试题
填空题
|
较难(0.4)
名校
解题方法
9. 某化学兴趣小组对绿矾(FeSO4•xH2O)的性质进行探究,进行以下实验:
(1)绿矾溶液的性质:取少量绿矾样品,在试管中加水溶解,滴加KSCN溶液,无明显现象。用力振荡后静置,溶液逐渐变红。所以实验室在保存绿矾溶液时,需要加入铁粉。用离子方程式解释加入铁粉的原因___ 。
(2)测定绿矾中结晶水的含量:称量两端带开关K1和K2的石英玻璃管(装置A)的质量,记为m1g。向石英玻璃管中装入一定量的样品,再次称量装置A的质量,记为m2g。按如图连接好装置进行实验(夹持仪器已略去)。
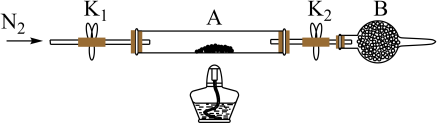
①仪器B的名称是___ ;
②实验时下列操作步骤次序正确的是:d→a→___ →e(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录数据,绿矾化学式中x=___ 。
实验时,如果按a→d→...的次序操作,则x的测定结果___ (填“偏大”、“偏小”或“无影响”)。
(3)探究硫酸亚铁的分解产物:将实验(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验结束后,反应管中残留固体为红色粉末。
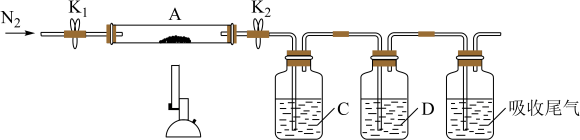
①C中的溶液为___ (填标号),D中可观察到的现象:有气泡冒出、___ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式___ 。
(1)绿矾溶液的性质:取少量绿矾样品,在试管中加水溶解,滴加KSCN溶液,无明显现象。用力振荡后静置,溶液逐渐变红。所以实验室在保存绿矾溶液时,需要加入铁粉。用离子方程式解释加入铁粉的原因
(2)测定绿矾中结晶水的含量:称量两端带开关K1和K2的石英玻璃管(装置A)的质量,记为m1g。向石英玻璃管中装入一定量的样品,再次称量装置A的质量,记为m2g。按如图连接好装置进行实验(夹持仪器已略去)。

①仪器B的名称是
②实验时下列操作步骤次序正确的是:d→a→
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录数据,绿矾化学式中x=
实验时,如果按a→d→...的次序操作,则x的测定结果
(3)探究硫酸亚铁的分解产物:将实验(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验结束后,反应管中残留固体为红色粉末。

①C中的溶液为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2020-03-01更新
|
542次组卷
|
2卷引用:云南省楚雄彝族自治州禄丰县第三中学2019-2020学年高三上学期期末考试理综化学试题
四、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
10. 二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
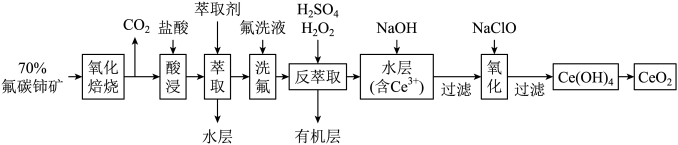
已知:
①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是___ 。
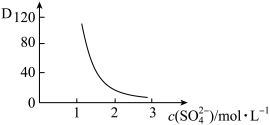
(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•H2n-4A2n+4H+。实验室中萃取时用到的主要玻璃仪器名称为___ ;如图中D是分配比,表示Ce4+分别在有机层中与水层中存在形式的物质的量浓度之比 。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:
。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:___ 。
(3)“反萃取”中,在稀硫酸和H2O2的作用下Ce4+转化为Ce3+,H2O2在该反应中的作用是___ (填“催化剂”“氧化剂”或“还原剂”)。
(4)“氧化”步骤的化学方程式为___ 。
(5)取上述流程中得到的CeO2产品0.43g,加硫酸溶解后,用0.1mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为___ 。

已知:
①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•H2n-4A2n+4H+。实验室中萃取时用到的主要玻璃仪器名称为
 。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:
。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:
(3)“反萃取”中,在稀硫酸和H2O2的作用下Ce4+转化为Ce3+,H2O2在该反应中的作用是
(4)“氧化”步骤的化学方程式为
(5)取上述流程中得到的CeO2产品0.43g,加硫酸溶解后,用0.1mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
11. (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为_____________________________ 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____ 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_________ (填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________ 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a =_________ cm。 (用含ρ、NA的计算式表示)

(3)下列有关的说法正确的是___________ 。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为_______ ,1mol Y2X2含有σ键的数目为__________ 。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是____________ 。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是______________________ 。
①基态Fe3+的M层电子排布式为
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为

(3)下列有关的说法正确的是
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
12. 相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

已知:Ⅰ.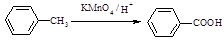
Ⅱ.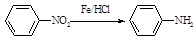 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子式是_________________ 。
(2)H的结构简式是________________ 。
(3)反应②③的类型是_____________ 、_______________ 。
(4)反应⑤的化学方程式是__________________________________ 。
(5)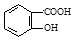 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有______ 种。
(6)请用合成反应流程图表示出由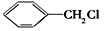 和其他无机物合成
和其他无机物合成 的最合理的方案(不超过4步)。例如:
的最合理的方案(不超过4步)。例如:_______________ 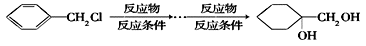

已知:Ⅰ.
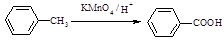
Ⅱ.
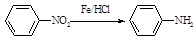 (苯胺,易被氧化)
(苯胺,易被氧化)请根据所学知识与本题所给信息回答下列问题:
(1)X的分子式是
(2)H的结构简式是
(3)反应②③的类型是
(4)反应⑤的化学方程式是
(5)
 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有(6)请用合成反应流程图表示出由
 和其他无机物合成
和其他无机物合成 的最合理的方案(不超过4步)。例如:
的最合理的方案(不超过4步)。例如:
您最近一年使用:0次
2016-12-09更新
|
499次组卷
|
3卷引用:2016届安徽省合肥一中高三下学期冲刺模拟理综化学A卷
2016届安徽省合肥一中高三下学期冲刺模拟理综化学A卷云南省楚雄彝族自治州禄丰县第三中学2019-2020学年高三上学期期末考试理综化学试题(已下线)第十单元 有机化学基础测试题-2021年高考化学一轮复习名师精讲练
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学反应原理、有机化学基础、化学实验基础、认识化学科学、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 二氧化硅的用途 碳酸氢钠的俗称、物理性质及用途 碳酸氢钠与酸反应 金属的化学腐蚀与电化学腐蚀 | |
| 2 | 0.65 | 苯的取代反应 苯的硝化实验探究 物质分离、提纯的常见化学方法 | |
| 3 | 0.65 | 苯的取代反应 苯的加成反应 | |
| 4 | 0.65 | 离子反应的发生条件 限定条件下的离子共存 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 6 | 0.85 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 7 | 0.65 | 原电池原理理解 原电池电极反应式书写 新型电池 | |
| 二、解答题 | |||
| 8 | 0.4 | 盖斯定律与热化学方程式 化学平衡状态的判断方法 温度对化学平衡移动的影响 化学平衡常数的有关计算 | 原理综合题 |
| 10 | 0.4 | 化学实验基础操作 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 11 | 0.65 | 物质结构与性质综合考查 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 晶体类型判断 | 结构与性质 |
| 12 | 0.65 | 同分异构体书写 醛类的银镜反应 根据题给物质选择合适合成路线 有机推断综合考查 | 实验探究题 |
| 三、填空题 | |||
| 9 | 0.4 | Fe2+的还原性 铁盐与亚铁盐鉴别试剂的选择 物质性质的探究 物质性质实验方案的设计 | |



