名校
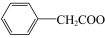
1 . 苯乙酸铜是合成优良催化剂、传感材料—纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:
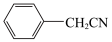
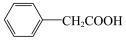

2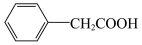
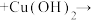 (
( )
)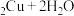
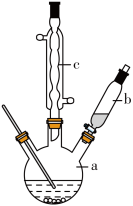
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是___________ ,其作用是___________ 。
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是___________ 。
(3)分离苯乙酸粗品的方法是___________ ,提纯粗苯乙酸的方法是___________ 。最终得到44g纯品,则苯乙酸的产率是___________ (保留两位有效数字)。
(4)用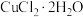 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________ 。

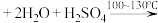
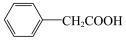

2
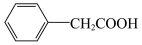
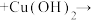 (
( )
)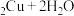
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
(3)分离苯乙酸粗品的方法是
(4)用
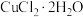 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2023-04-30更新
|
206次组卷
|
4卷引用:T28-实验题
名校
解题方法
2 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
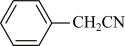


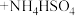
2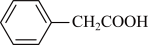
 (
(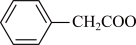 )
)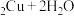
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
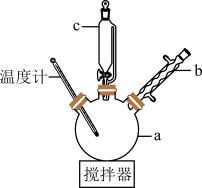
步骤一:将a中所加的硫酸溶液加热至100℃,缓缓滴入40.0g苯乙腈,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品并进行提纯。
步骤二:用 和
和 溶液制备适量
溶液制备适量 沉淀,并用蒸馏水多次洗涤沉淀。
沉淀,并用蒸馏水多次洗涤沉淀。
步骤三:将苯乙酸加入乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
回答下列问题:
(1)仪器a的名称是___________ 。仪器b的作用是___________ 。与普通分液漏斗相比,仪器c的优点是___________ 。
(2)制备苯乙酸时,最合适的加热方法是___________ (a.水浴,b.油浴,c.直接加热,填标号)。
(3)步骤一中加适量冷水的目的是___________ ,步骤三中加入乙醇的目的是___________ 。
(4)提纯粗苯乙酸的方法是___________ ,得到42.1g苯乙酸纯品,则苯乙酸的产率是___________ (保留三位有效数字)。



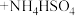
2
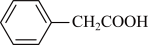
 (
( )
)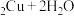
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

步骤一:将a中所加的硫酸溶液加热至100℃,缓缓滴入40.0g苯乙腈,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品并进行提纯。
步骤二:用
 和
和 溶液制备适量
溶液制备适量 沉淀,并用蒸馏水多次洗涤沉淀。
沉淀,并用蒸馏水多次洗涤沉淀。步骤三:将苯乙酸加入乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度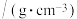 |
| 苯乙腈 | 117 | -48 | 197 | 微溶于冷水,易溶于乙醇 | 1.08 |
| 苯乙酸 | 136 | 76.5 | 161 | 微溶于冷水,易溶于乙醇 | 1.17 |
(1)仪器a的名称是
(2)制备苯乙酸时,最合适的加热方法是
(3)步骤一中加适量冷水的目的是
(4)提纯粗苯乙酸的方法是
您最近一年使用:0次
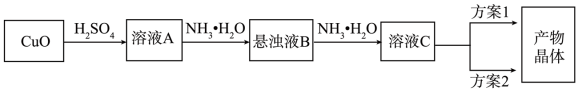
3 . 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
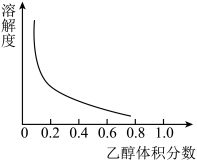
请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是_____ 。
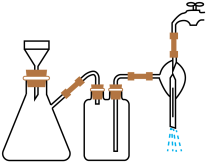
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有_____ 杂质,产生该杂质的原因是______ 。
(2)方案2的实验步骤为:a.向溶液C中加入适量____ ,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________ 。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:____________ 。
③步骤d采用________ 干燥的方法。

相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+
 Cu2++4NH3
Cu2++4NH3②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图

请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是

A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有
(2)方案2的实验步骤为:a.向溶液C中加入适量
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:
③步骤d采用
您最近一年使用:0次
2019-06-29更新
|
362次组卷
|
2卷引用:2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业
名校
4 . 工业上利用焦炭和水蒸气发生如下的两个反应:①C(s)+H2O(g) CO(g)+H2(g)、②CO(g)+H2O(g)
CO(g)+H2(g)、②CO(g)+H2O(g) CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
 CO(g)+H2(g)、②CO(g)+H2O(g)
CO(g)+H2(g)、②CO(g)+H2O(g) CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是
CO2(g)+H2(g),以生成的H2为原料合成NH3。在“侯氏制碱法”中,以NH3为原料可以制备小苏打,将得到的小苏打热分解即得纯碱。下列实验设计正确且能达到目的的是A.制备NH3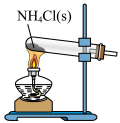 | B.干燥NH3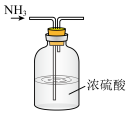 |
C.收集NH3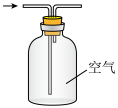 | D.吸收多余的NH3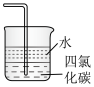 |
您最近一年使用:0次
2024-02-23更新
|
777次组卷
|
4卷引用:河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期3月月考化学试题
河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期3月月考化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题江苏省无锡市第一中学2023-2024学年高三上学期10月份质量检测化学试题
2024高三下·全国·专题练习
解题方法
5 . 三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。
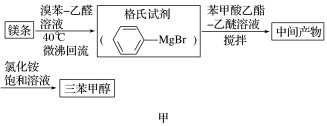

已知:①格氏试剂容易水解: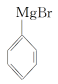 +H2O→
+H2O→ +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)
②相关物质的物理性质如下:
③三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
请回答以下问题:
(1)图乙中玻璃仪器B的名称为___________ ;装有无水CaCl2的仪器A的作用是___________ 。
(2)图乙中滴加液体未用普通分液漏斗而用滴液漏斗的作用是___________ ;
制取格氏试剂时要保持微沸,可以采用___________ 加热方式。
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:

其中,操作Ⅰ为___________ ;洗涤液最好选用___________ (填字母);
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为___________ 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为___________ 。
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图甲所示,装置如图乙所示。

已知:①格氏试剂容易水解:
 +H2O→
+H2O→ +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)②相关物质的物理性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 三苯甲醇 | 164.2 | 380 | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3 | 34.6 | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7 | 156.2 | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6 | 212.6 | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
请回答以下问题:
(1)图乙中玻璃仪器B的名称为
(2)图乙中滴加液体未用普通分液漏斗而用滴液漏斗的作用是
制取格氏试剂时要保持微沸,可以采用
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:

其中,操作Ⅰ为
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为
您最近一年使用:0次
名校
6 . 在无水三氯化铝的催化作用下,利用乙醇制备乙烯的反应温度是 。某兴趣小组据此设计如下图所示实验,合成无水
。某兴趣小组据此设计如下图所示实验,合成无水 并完成乙烯的制备及收集。
并完成乙烯的制备及收集。
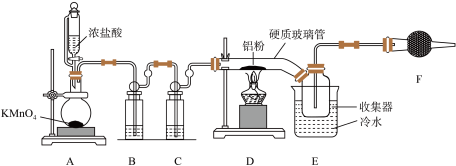
Ⅰ.无水 的制备
的制备
(1) 中盛装浓盐酸的仪器名称为
中盛装浓盐酸的仪器名称为___________ 。
(2)装置 中发生的化学方程式为
中发生的化学方程式为___________ 。
(3)硬质玻璃管直接接入收集器的优点是___________ 。
(4)装置F中的药品名称是___________ 。
Ⅱ.乙烯的制备及收集
实验过程:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL无水乙醇,点燃酒精灯加热。

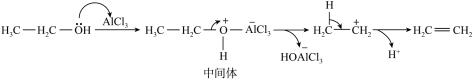
(5)该催化机理如下图所示,写出此反应历程中生成 的反应方程式
的反应方程式___________ 。
(6)实验装置中还缺少的仪器是___________ 。加入药品后,开始实验前,应先打开止水夹___________ (填“1”、“2”或“1”和“2”),反应进行一段时间后,出现现象___________ ,再关闭相应止水夹。
(7)B中无水氯化钙的作用是___________ 。
(8)与教材中用乙醇和浓硫酸制备乙烯相比,用三氯化铝做催化剂制备乙烯的优点有___________ (任写两点)。
 。某兴趣小组据此设计如下图所示实验,合成无水
。某兴趣小组据此设计如下图所示实验,合成无水 并完成乙烯的制备及收集。
并完成乙烯的制备及收集。
Ⅰ.无水
 的制备
的制备(1)
 中盛装浓盐酸的仪器名称为
中盛装浓盐酸的仪器名称为(2)装置
 中发生的化学方程式为
中发生的化学方程式为(3)硬质玻璃管直接接入收集器的优点是
(4)装置F中的药品名称是
Ⅱ.乙烯的制备及收集
实验过程:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL无水乙醇,点燃酒精灯加热。

(5)该催化机理如下图所示,写出此反应历程中生成
 的反应方程式
的反应方程式
(6)实验装置中还缺少的仪器是
(7)B中无水氯化钙的作用是
(8)与教材中用乙醇和浓硫酸制备乙烯相比,用三氯化铝做催化剂制备乙烯的优点有
您最近一年使用:0次
名校
解题方法
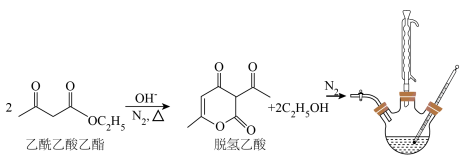
7 . 脱氢乙酸是一种重要的有机合成中间体和低毒高效食品防腐剂,实验室以乙酰乙酸乙酯为原料,在OH-的催化作用下制备脱氢乙酸的反应原理和实验装置如图(夹持和加热装置已省略):
Ⅰ.脱氢乙酸的合成
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是___________ 。
(2)步骤Ⅰ中②过程中不需要用到的仪器为___________ (填字母)。___________ ℃、___________ h、___________ 作催化剂。与其他催化剂相比,所选催化剂使脱氢乙酸产率最高的原因可能为___________ 。___________ ,漏斗的作用为___________ 。
(5)脱氢乙酸的产率约为___________(填字母)。
| 名称 | 相对分子质量 | 性状 | 密度/ | 熔点/℃ | 沸点/℃ | 物理性质 |
| 乙酰乙酸乙酯 | 130 | 无色透明液体 | 1.03 | -39 | 180.8 | 微溶于水,易溶于乙醇等有机溶剂 |
| 脱氢乙酸 | 168 | 白色晶体 | — | 109~111 | 269.9 | 微溶于乙醇和冷水,具有较强的还原性 |
| 乙醇 | 46 | 无色透明液体 | 0.79 | -114.1 | 78.3 | 与水任意比例互溶,易溶于有机溶剂 |
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
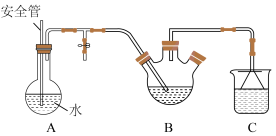
(1)步骤Ⅰ中通入N2的目的是
(2)步骤Ⅰ中②过程中不需要用到的仪器为


(5)脱氢乙酸的产率约为___________(填字母)。
| A.54% | B.64% | C.74% | D.84% |
您最近一年使用:0次
2024-04-02更新
|
566次组卷
|
5卷引用:黑龙江省哈尔滨市三校联考2024届高三二模化学试题
黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)东北三省2024届高三下学期三校二模联考化学试题2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
名校
8 . 氮化钙(Ca3N2)是一种重要的化学试剂,某化学兴趣小组拟制备氮化钙并测定产品纯度。
已知:①氮化钙极易与水反应;
②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;
③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验:
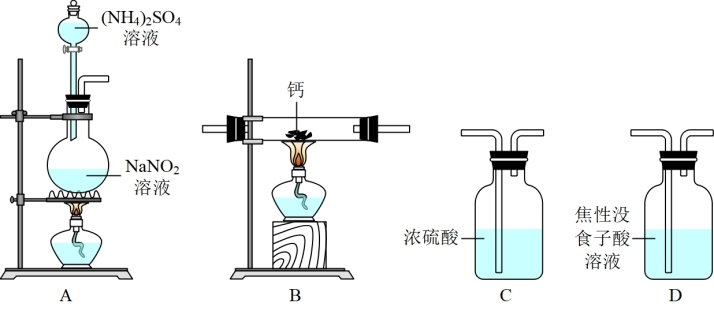
(1)装置A中反应容器的名称为___________ ,A中发生反应的离子方程式:___________ 。
(2)气体从左至右,装置连接顺序为___________ (填标号,装置可重复使用)。
(3)实验步骤如下:___________ (请按正确的顺序填入下列步骤的代号)。
①加热B处的酒精灯;
②检查装置气密性;
③打开分液漏斗活塞,加热A处的酒精灯;。
④停止加热A处的酒精灯;
⑤停止加热B处的酒精灯;
⑥装入药品。
II.测定产品纯度
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。
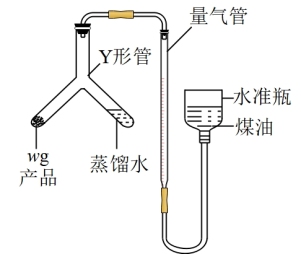
(4)氮化钙与水反应的化学方程式为___________ 。
(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。使产品与蒸馏水接触反应的操作是:将Y形管___________ (填“ 左倾”或“右倾”)。
(6)实验中取产品质量为w g,开始量气管读数为V1 mL(量气管“0”刻度线在仪器。上方),最终量气管读数为V2mL(折合成标准状况),则该样品纯度为___________ (用代数式表示)。如果开始仰视刻度线,终点时俯视刻度线,则测得结果___________ (填“ 偏高”“偏低”或“无影响”)。
已知:①氮化钙极易与水反应;
②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;
③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验:

(1)装置A中反应容器的名称为
(2)气体从左至右,装置连接顺序为
(3)实验步骤如下:
①加热B处的酒精灯;
②检查装置气密性;
③打开分液漏斗活塞,加热A处的酒精灯;。
④停止加热A处的酒精灯;
⑤停止加热B处的酒精灯;
⑥装入药品。
II.测定产品纯度
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。

(4)氮化钙与水反应的化学方程式为
(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。使产品与蒸馏水接触反应的操作是:将Y形管
(6)实验中取产品质量为w g,开始量气管读数为V1 mL(量气管“0”刻度线在仪器。上方),最终量气管读数为V2mL(折合成标准状况),则该样品纯度为
您最近一年使用:0次
9 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
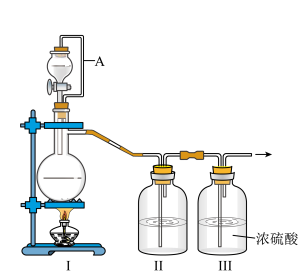
为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________ 。
③装置Ⅶ的作用是________________________________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净的Cl2 | MnO2 | ① | ② |
| 制备纯净的NO | Cu | ③ | ④ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
2017-03-07更新
|
4680次组卷
|
18卷引用:河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题
河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题湖北省荆州中学2018届高三4月月考理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升高一必修第二册(人教2019版)第五章 素养检测山西省晋城市陵川县高级实验中学2020-2021学年高一下学期3月月考化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验福建省莆田第六中学2018届高三上学期期中考试化学试题甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题山东省枣庄市2021届高三上学期第三次质量检测化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题



