解题方法
1 . 实验室里要配制465mL0.2mol·L-1的硫酸钠溶液。请填写下列空白:
A.计算、称量、溶解:在天平上称出___________ g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.转移:把得到的溶液冷却后小心地沿着___________ 注入___________ 中。
C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用___________ 小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
A.计算、称量、溶解:在天平上称出
B.转移:把得到的溶液冷却后小心地沿着
C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
您最近半年使用:0次
解题方法
2 . 实验室需要950mL0.5mol·L-1的稀硫酸和480mL1mol·L-1NaOH溶液进行实验,请你用98%的浓硫酸(ρ=1.84g·mL-1)和NaOH固体进行配制。回答下列问题:
(1)配制稀硫酸时,需要使用的玻璃仪器有量筒、烧杯、胶头滴管、_________ (写仪器名称)。
(2)配制稀硫酸时,需要量取98%的浓硫酸________ mL,应选用下列量器中的_________ (填字母)。
A.5mL量筒 B.10mL量筒 C.25mL量筒 D.50mL量筒
(3)稀释浓硫酸的操作是___________ 。
(4)对所配制的稀硫酸进行测定,发现其浓度为0.48mol·L-1,下列各项操作可能引起该误差的是___________ (填字母)
A.用量筒量取浓硫酸读数时仰视刻度线
B.转移稀释的硫酸溶液后未洗涤烧杯和玻璃棒
C.浓硫酸稀释后未经冷却即转移到容量瓶中
D.容量瓶未干燥就用来配制溶液
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平
(1)配制稀硫酸时,需要使用的玻璃仪器有量筒、烧杯、胶头滴管、
(2)配制稀硫酸时,需要量取98%的浓硫酸
A.5mL量筒 B.10mL量筒 C.25mL量筒 D.50mL量筒
(3)稀释浓硫酸的操作是
(4)对所配制的稀硫酸进行测定,发现其浓度为0.48mol·L-1,下列各项操作可能引起该误差的是
A.用量筒量取浓硫酸读数时仰视刻度线
B.转移稀释的硫酸溶液后未洗涤烧杯和玻璃棒
C.浓硫酸稀释后未经冷却即转移到容量瓶中
D.容量瓶未干燥就用来配制溶液
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
3 . 食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25℃时,HAc的Ka=1.75×105=10-4.76。
(1)配制 的HAc溶液,需
的HAc溶液,需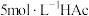 溶液的体积为
溶液的体积为___________ mL。
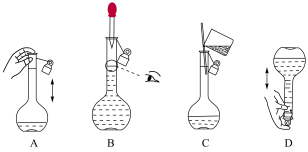
(2)下列关于 容量瓶的操作,正确的是
容量瓶的操作,正确的是___________ 。
(1)配制
 的HAc溶液,需
的HAc溶液,需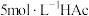 溶液的体积为
溶液的体积为(2)下列关于
 容量瓶的操作,正确的是
容量瓶的操作,正确的是
您最近半年使用:0次
名校
解题方法
4 . 某实验小组在进行氯水的性质实验时需要使用需要使用240mL、 的
的 溶液,现欲利用实验室现有药品
溶液,现欲利用实验室现有药品 来配制所需溶液,请按要求填空:
来配制所需溶液,请按要求填空:
(1)用托盘天平称取所需 的质量为
的质量为_______ g。
(2)实验台现有烧杯、量筒、玻璃棒、托盘天平(带砝码),还需要的玻璃仪器是_______ 。
(3)下列操作的正确顺序为_______ (填标号)。
A.将称量好的固体放入烧杯中加水搅拌溶解
B.反复颠倒摇匀
C.定容
D.冷却后转移,洗涤烧杯、玻璃棒,洗涤液也转移入容器中
E.将配制好的溶液转入试剂瓶中贴上标签
(4)在配制过程中,下列操作对所配制的溶液的物质的量浓度有何影响? (填“偏高”“偏低”或“无影响”)。
A.称量时,若物品和砝码的位置放反了_______
B.未冷却到室温就将溶液转移到容量瓶并定容_______
C.定容时俯视刻度线_______
(5)取用任意体积的该溶液时,下列物理量中不随所取体积的多少而变化的是_______。
(6)学生欲用上述所配制的溶液加蒸馏水稀释得到100ml 溶液,该学生需要用量筒量取
溶液,该学生需要用量筒量取_______ mL上述溶液进行配制。
 的
的 溶液,现欲利用实验室现有药品
溶液,现欲利用实验室现有药品 来配制所需溶液,请按要求填空:
来配制所需溶液,请按要求填空:(1)用托盘天平称取所需
 的质量为
的质量为(2)实验台现有烧杯、量筒、玻璃棒、托盘天平(带砝码),还需要的玻璃仪器是
(3)下列操作的正确顺序为
A.将称量好的固体放入烧杯中加水搅拌溶解
B.反复颠倒摇匀
C.定容
D.冷却后转移,洗涤烧杯、玻璃棒,洗涤液也转移入容器中
E.将配制好的溶液转入试剂瓶中贴上标签
(4)在配制过程中,下列操作对所配制的溶液的物质的量浓度有何影响? (填“偏高”“偏低”或“无影响”)。
A.称量时,若物品和砝码的位置放反了
B.未冷却到室温就将溶液转移到容量瓶并定容
C.定容时俯视刻度线
(5)取用任意体积的该溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中 的物质的量 的物质的量 | B.溶液的浓度 |
C.溶液中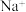 的数目 的数目 | D.溶液的密度 |
 溶液,该学生需要用量筒量取
溶液,该学生需要用量筒量取
您最近半年使用:0次
2022-10-17更新
|
220次组卷
|
2卷引用:章末检测卷(二) 海水中的重要元素——钠和氯
22-23高一上·全国·课时练习
解题方法
5 . 实验室用2.0mol/L NaCl溶液配制100mL 0.50mol/L NaCl溶液。
请回答下列问题。
(1)配制上述溶液,需要2.0mol/L NaCl溶液_______ mL。
(2)容量瓶上标有_______ 。(填序号)
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
(3)下列主要操作步骤的正确顺序是_______ 。(填序号)
①量取一定体积的氯化钠溶液,放入烧杯中,用适量蒸馏水稀释;
②向容量瓶中加水至液面离容量瓶刻度线下1~2cm,改用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③将溶液转移到100mL容量瓶中;
④盖好瓶塞,反复翻转,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)配制过程中出现以下情况,使所配溶液浓度偏高的是_______。
请回答下列问题。
(1)配制上述溶液,需要2.0mol/L NaCl溶液
(2)容量瓶上标有
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
(3)下列主要操作步骤的正确顺序是
①量取一定体积的氯化钠溶液,放入烧杯中,用适量蒸馏水稀释;
②向容量瓶中加水至液面离容量瓶刻度线下1~2cm,改用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③将溶液转移到100mL容量瓶中;
④盖好瓶塞,反复翻转,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)配制过程中出现以下情况,使所配溶液浓度偏高的是_______。
| A.没有洗涤烧杯和玻璃棒 |
| B.定容时俯视容量瓶的刻度线 |
| C.转移时,因操作不当使部分NaCl溶液溅出瓶外 |
| D.定容时溶液凹液面低于容量瓶刻度线 |
您最近半年使用:0次
21-22高二下·四川成都·期末
名校
解题方法
6 . 下图是某同学用500mL容量瓶配制 NaOH溶液的过程:
NaOH溶液的过程:
 NaOH溶液的过程:
NaOH溶液的过程:
| A.如图所示,用托盘直接称量2.0g烧碱 |
| B.配制的正确顺序为①④③⑤②⑥ |
| C.②中定容时仰视刻线会导致溶液浓度偏高 |
| D.能用容量瓶贮存配制好的溶液 |
您最近半年使用:0次
2022-07-07更新
|
2422次组卷
|
16卷引用:海水中的重要元素—钠和氯——课时7物质的量浓度
(已下线)海水中的重要元素—钠和氯——课时7物质的量浓度四川省成都市2021-2022学年高二下学期摸底考试化学试题(已下线)第13讲 物质的量浓度-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )河南省宋基信阳实验中学2022-2023学年高三上学期9月月考化学试题天津市天津中学2022-2023学年高一上学期期中考试化学试题内蒙古乌兰浩特第一中学2022-2023学年高一上学期第三次月考化学试题山东省淄博市临淄中学2022-2023学年高一上学期期末考试化学试题湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题陕西省宝鸡市渭滨区2022-2023学年高一年级上学期期末考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高一下学期第一次月考化学试题四川省成都经济技术开发区实验中学校2022-2023学年高二下学期5月月考化学试题内蒙古巴彦淖尔市第一中学2022-2023学年高一上学期1月期末考试化学试题福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题福建省厦门第一中学2023-2024学年高一上学期第二次月考化学试卷云南师范大学附属中学2023-2024学年高一下学期第一次月考化学试题福建省厦门大学附属实验中学2023—2024学年高一上学期第二次月考化学试卷
名校
解题方法
7 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制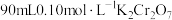 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有___________ 、___________ 。
②计算,称量:需用天平称量___________ 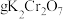 固体(
固体(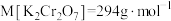 )。
)。
③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先___________ ,再改用胶头滴管加水至溶液凹液面最低处与刻度线相切。
④下列操作使结果偏低的是___________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ 。
②请配平步骤②中发生反应的离子反应方程式:___________
6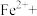 1
1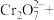 □
□ =□
=□ □
□ □
□ 。
。
③实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
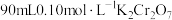 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有
②计算,称量:需用天平称量
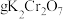 固体(
固体(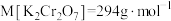 )。
)。③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先
④下列操作使结果偏低的是
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
| 步骤一 | 取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入0.10mol/L酸性 溶液10mL时,恰好完全反应 溶液10mL时,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
6
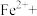 1
1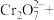 □
□ =□
=□ □
□ □
□ 。
。③实验测得黑木耳中铁元素的质量分数为
您最近半年使用:0次
2022-01-19更新
|
460次组卷
|
5卷引用:研究与实践2 检验食品中的铁元素
2014高三·全国·专题练习
名校
8 . 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用,请回答下列问题:
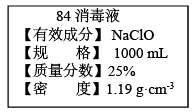
(1)该“84消毒液”的物质的量浓度约为___ mol·L-1。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是___ (填字母)。
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为___ mol·L-1;
②需用浓硫酸的体积为____ mL。

(1)该“84消毒液”的物质的量浓度约为
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=
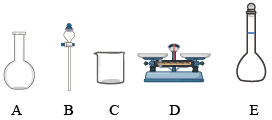
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是

| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0g |
①所配制的稀硫酸中,H+的物质的量浓度为
②需用浓硫酸的体积为
您最近半年使用:0次
2021-09-16更新
|
652次组卷
|
24卷引用:第一章章末检测(2)——《高中新教材同步备课》(鲁科版 必修第一册)
(已下线)第一章章末检测(2)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2015-2016学年北大附中河南分校高一上9月考化学试卷2017届福建省南安一中高三暑假阶段性考试化学试卷河南省安阳县第一高级中学2017-2018学年高一上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第2讲 物质的量浓度及一定物质的量浓度溶液的配制【押题专练】吉林省长春市九台区师范高级中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第2讲 物质的量在化学实验中的应用( 题型专练)(已下线)2018年12月22日 《每日一题》人教必修1- 周末培优河北省大名县第一中学2018-2019学年高二(普通班)5月月考化学试题第一章章末检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)河北省辛集中学2019-2020学年高一上学期第一次月考(理)化学试题山东省东明县第一中学2019-2020学年高一上学期第一次月考化学试题(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)黑龙江省大庆中学2020—2021学年高一下学期开学考试化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题二 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省黑河市第九中学2022-2023学年高三上学期摸底考试化学试题湖南省衡阳县四中2022-2023学年高一上学期开学摸底考试化学试题(B卷)山东省曹县第一中学2023-2024学年高一上学期10月月考化学试题
20-21高一上·内蒙古巴彦淖尔·期中
解答题-实验探究题
|
较易(0.85)
|
名校
解题方法
9 . 要配制480mL 0.2mol·L-1的FeSO4溶液,配制过程中有如下操作步骤:
①把称量好的绿矾(FeSO4·7H2O)放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入___________ 中;
③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用___________ 滴加蒸馏水至液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,反复上下颠倒,摇匀; ⑥待溶液恢复到室温。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)___________ ,完成此配制实验,除了量筒、烧杯、玻璃棒外还需要的常见的玻璃仪器有___________ 。
(2)实验室用绿矾(FeSO4·7H2O)来配制该溶液,用托盘天平称量绿矾___________ g。
(3)由于错误操作,使得实际浓度比所要求的偏小的是___________ (填写编号)。
A.称量绿矾时,左码右物
B.使用容量瓶配制溶液时,俯视液面定容,
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
(4)定容时,若加蒸馏水时不慎超过刻度线,处理方法是___________
①把称量好的绿矾(FeSO4·7H2O)放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入
③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,反复上下颠倒,摇匀; ⑥待溶液恢复到室温。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)
(2)实验室用绿矾(FeSO4·7H2O)来配制该溶液,用托盘天平称量绿矾
(3)由于错误操作,使得实际浓度比所要求的偏小的是
A.称量绿矾时,左码右物
B.使用容量瓶配制溶液时,俯视液面定容,
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
(4)定容时,若加蒸馏水时不慎超过刻度线,处理方法是
您最近半年使用:0次
2021-07-28更新
|
1651次组卷
|
8卷引用:2.3.3 物质的量浓度-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)2.3.3 物质的量浓度-2021-2022学年高一化学课后培优练(人教版2019必修第一册)内蒙古杭锦后旗奋斗中学2020-2021学年高一上学期期中考试化学试题(已下线)专题2.3.4 配制一定物质的量浓度的溶液(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)必考点10 以物质的量为中心的化学计算-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)(已下线)第二章 海水中的重要元素——钠和氯(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)江苏省扬州中学2022-2023学年高一上学期期中检测化学试题河南省潢川第一中学2022-2023学年高一上学期期末考试化学试题河北省唐县第一中学2023-2024学年高一上学期开学考试化学试题
20-21高二下·河北石家庄·期末
名校
解题方法
10 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应)
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②用一粒研碎后的药片(0.10g)中加入2.0mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下到问题:
(1)正确操作顺序是_______ (填序号)。
(2)测定过程中发生反应的离子方程式为_______ 。
(3)该测定实验共进行4次。实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制盐酸度选用的容量瓶的规格为_______ ,理由是_______ 。
(4)某同学次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为_______ %(保留3位有效数字)。
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②用一粒研碎后的药片(0.10g)中加入2.0mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下到问题:
(1)正确操作顺序是
(2)测定过程中发生反应的离子方程式为
(3)该测定实验共进行4次。实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制盐酸度选用的容量瓶的规格为
(4)某同学次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]mL | 17.00 | 12.90 | 13.10 | 13.00 |
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为
您最近半年使用:0次



