名校
1 . 选择下列实验方法分离、提纯物质,将分离、提纯方法的字母填在横线上。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物:___________ 。
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:___________ 。
(3)提取碘水中的碘:___________ 。
(4)除去混在乙烷中的乙烯:___________ 。
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:___________ 。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物:
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:
(3)提取碘水中的碘:
(4)除去混在乙烷中的乙烯:
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:
您最近一年使用:0次
2022-02-14更新
|
1689次组卷
|
5卷引用:【知识图鉴】单元讲练测选择性必修3第1单元01讲核心
(已下线)【知识图鉴】单元讲练测选择性必修3第1单元01讲核心2016-2017学年内蒙古集宁一中高二下月考二化学卷课前-1.2.1 有机化合物的分离、提纯-人教2019选择性必修3(已下线)第03讲 有机物的分离、提纯(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)安徽省安庆市第七中学2021-2022学年高二下学期3月阶段性考试化学试题
名校
解题方法
2 . 工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ ,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ ,通过计算即可确定上述方案是否可行。
(1)为除去溶液中的Fe2+,可先加入
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
2021-08-24更新
|
1679次组卷
|
9卷引用:课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析
课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析3.4.2沉淀溶解平衡原理的应用 课后河南省洛阳市2020-2021学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山东省莱西市第一中学2020-2021学年高二上学期12月月考化学试题吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
3 . 粗盐中除含有泥沙等难溶性杂质外,还含有 、
、 和
和 等可溶性杂质,现欲得到纯净的氯化钠晶体,需经过多步操作。
等可溶性杂质,现欲得到纯净的氯化钠晶体,需经过多步操作。
试回答:
(1)将粗盐溶于水,得到悬浊液,为除去难溶性杂质,需要选用的玻璃仪器有_______ 。
(2)欲除去粗盐溶液中的 、
、 和
和 ,应向粗盐溶液中依次加入过量的NaOH溶液、
,应向粗盐溶液中依次加入过量的NaOH溶液、_______ (填化学式,后同)溶液、_________ 溶液,然后过滤。
(3)向(2)中所得滤液中滴加__________ 至无气泡产生,反应的离子方程式为__________ ,再经蒸发结晶得到氯化钠晶体。
 、
、 和
和 等可溶性杂质,现欲得到纯净的氯化钠晶体,需经过多步操作。
等可溶性杂质,现欲得到纯净的氯化钠晶体,需经过多步操作。试回答:
(1)将粗盐溶于水,得到悬浊液,为除去难溶性杂质,需要选用的玻璃仪器有
(2)欲除去粗盐溶液中的
 、
、 和
和 ,应向粗盐溶液中依次加入过量的NaOH溶液、
,应向粗盐溶液中依次加入过量的NaOH溶液、(3)向(2)中所得滤液中滴加
您最近一年使用:0次
2020-10-08更新
|
307次组卷
|
4卷引用:高一必修第一册(鲁科2019)第2章第2节 电解质的电离 离子反应 教材帮
解题方法
4 . 为除去粗盐中的 、
、 、
、 以及泥沙,某同学设计了一种制备精盐的实验方案,步骤如下:
以及泥沙,某同学设计了一种制备精盐的实验方案,步骤如下:
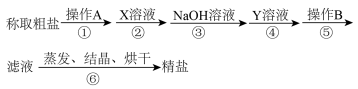
(1)操作A是_______________ ,操作B是_______________ 。
(2)写出第④步中涉及反应的化学方程式:____________________ 、______________________ 。
(3)经操作B得到的固体成分有:泥沙、 、
、 、
、____________ (填化学式)。
(4)此实验方案尚需完善,具体步骤是______________________________ 。
 、
、 、
、 以及泥沙,某同学设计了一种制备精盐的实验方案,步骤如下:
以及泥沙,某同学设计了一种制备精盐的实验方案,步骤如下:
(1)操作A是
(2)写出第④步中涉及反应的化学方程式:
(3)经操作B得到的固体成分有:泥沙、
 、
、 、
、(4)此实验方案尚需完善,具体步骤是
您最近一年使用:0次
5 . 镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。如图是工业上提镁的流程。
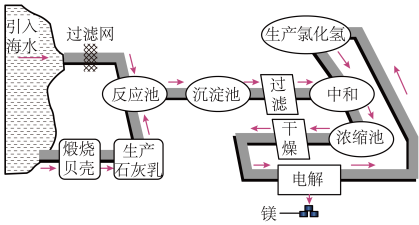
(1)电解熔融MgCl2制金属镁的化学方程式是________ 。
(2)“反应池’→……→‘中和’”过程的主要作用:①除去海水中的其他杂质;②________ 。
(3)“中和”时,Mg(OH)2与盐酸发生反应的离子方程式是________ 。
(4)在上述流程中,可循环使用的物质是________ 。

(1)电解熔融MgCl2制金属镁的化学方程式是
(2)“反应池’→……→‘中和’”过程的主要作用:①除去海水中的其他杂质;②
(3)“中和”时,Mg(OH)2与盐酸发生反应的离子方程式是
(4)在上述流程中,可循环使用的物质是
您最近一年使用:0次
解题方法
6 . (1)Na2CO3固体中混有少量NaHCO3固体,除去杂质的方法是________________ ,化学方程式是___________________________________ 。
(2)NaHCO3固体中混有少量Na2CO3固体,除杂方法是________________ ,化学方程式是________________________________________________________ 。
(3)NaOH固体中混有少量Na2CO3固体,除杂方法是________________ ,反应的离子方程式是_______________________________________________________ 。
(2)NaHCO3固体中混有少量Na2CO3固体,除杂方法是
(3)NaOH固体中混有少量Na2CO3固体,除杂方法是
您最近一年使用:0次
2018-08-09更新
|
595次组卷
|
4卷引用:人教版新教材化学同步2.1.2 钠的几种化合物 练习(1)
人教版新教材化学同步2.1.2 钠的几种化合物 练习(1)(已下线)2.1.2 钠的几种化合物 练习(2)——《高中新教材同步备课》(人教版 必修第一册)2018年高一化学(人教版)必修1综合题型练习卷:几种重要的金属化合物湖北省十堰市区县普通高中联合体2021-2022学年高一上学期期中联考化学试题
解题方法
7 . 溴碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。实验室提取碘的途径如下所示:

(1)碘元素在海水中以________ 存在(填“游离态”或“化合态”)。
(2)灼烧过程中用到的实验仪器有铁三角架、酒精灯、______ 、_____ 、______ 。
(3)操作①中需用到玻璃棒,则玻璃棒的作用是_______________ 。
(4)向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________ 。
(5)操作③是分液,则操作②是___________ ;操作④是_____________ 。

(1)碘元素在海水中以
(2)灼烧过程中用到的实验仪器有铁三角架、酒精灯、
(3)操作①中需用到玻璃棒,则玻璃棒的作用是
(4)向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为
(5)操作③是分液,则操作②是
您最近一年使用:0次
名校
8 . 食盐是人类生活中不可缺少的物质,海水中含有大量食盐。某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。
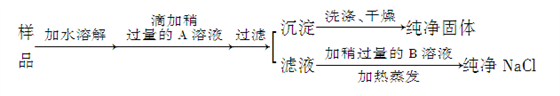
请回答:
(1)加入的A是__________ ,检验A已过量的方法是___________ 。
(2)加入的B是__________ ,加入稍过量B的目的是__________ 。
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入_________________ 溶液。

请回答:
(1)加入的A是
(2)加入的B是
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入
您最近一年使用:0次
2017-09-13更新
|
853次组卷
|
7卷引用:人教版2019必修第二册 第五章 第一节 第2课时 硫酸 硫酸根离子的检验
人教版2019必修第二册 第五章 第一节 第2课时 硫酸 硫酸根离子的检验河南省周口市中英文学校2018届高三上学期开学摸底考试化学试题江西省南昌市第十中学2019-2020学年高一上学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期期末考试化学试题山西省晋中市寿阳县第一中学2019—2020学年高一上学期第二次月考化学试题内蒙古包头市一机一中2021-2022学年高一上学期10月月考化学试题(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
13-14高一·全国·课时练习
解题方法
9 . 海水的综合利用可以制备金属镁,其流程如下图所示:

(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________ 。
②过滤:__________________________ 。
③蒸发:________________ 。

(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:
②过滤:
③蒸发:
您最近一年使用:0次
2014-04-02更新
|
634次组卷
|
8卷引用:2014年高一化学人教版必修2 4.1.2海水资源的开发利用练习卷
(已下线)2014年高一化学人教版必修2 4.1.2海水资源的开发利用练习卷(已下线)同步君 必修2 第4章 第1节 海水资源的开发利用高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用(已下线)2018年5月27日 每周一测——《每日一题》2017-2018学年高一化学人教必修2(已下线)2019年5月26日 《每日一题》 必修2 每周一测人教版高中化学必修2第四章《化学与自然资源的开发利用》测试卷1人教版高中化学必修二第四章《化学与自然资源的开发利用》测试卷人教版高中化学必修2第四章《化学与自然资源的开发利用》测试卷2



