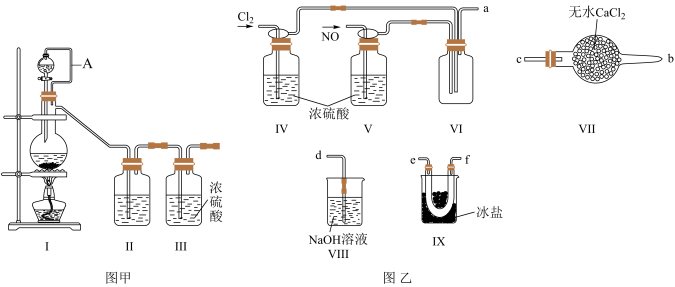
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | 浓盐酸 | ① |
| 制备纯净NO | Cu | 稀硝酸 | ② |
①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、Cl2通入装置Ⅴ中,你同意此观点吗?你的理由是
④实验开始的时候,先通入氯气,再通入NO,原因为

| A.b球形干燥管中装有氯化钙,用于除去气体中的水蒸气 |
| B.测定气体总体积必须关闭K1、K2,打开K3 |
C.量筒Ⅰ用于测二氧化碳的量,干燥管 中装入碱石灰,量筒Ⅱ用于测氧气的量 中装入碱石灰,量筒Ⅱ用于测氧气的量 |
| D.读完气体总体积后,关闭K3,缓缓打开K1、K2;可观察到Q气球慢慢缩小 |
 是一种新型的环保饮用水消毒剂。课题小组拟选择下列部分装置制备并收集一定量的二氧化氯(转置不可重复使用):
是一种新型的环保饮用水消毒剂。课题小组拟选择下列部分装置制备并收集一定量的二氧化氯(转置不可重复使用):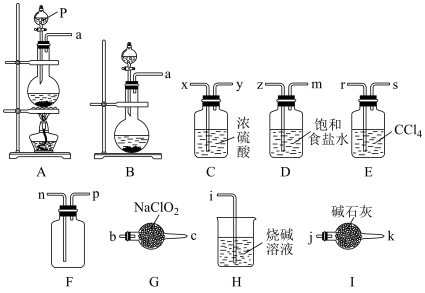
已知:①常温下,
 可用
可用 固体与
固体与 反应制得;
反应制得;②
 易溶于有机溶剂,
易溶于有机溶剂, 是一种易溶于水而难溶于有机溶剂的气体,氧化性比氯气强;
是一种易溶于水而难溶于有机溶剂的气体,氧化性比氯气强;回答下列问题:
(1)仪器P的名称为
(2)制备二氧化氯:导管口连接顺序为:a→
(3)写出G中发生反应的化学方程式:
(4)装置E的作用是:
(5)若用100mL 2 mol·L-1的浓盐酸与足量的
 制备
制备 ,则被氧化的HCl的物质的量是___________(填序号)。
,则被氧化的HCl的物质的量是___________(填序号)。| A.>0.1 mol | B.0.1 mol | C.<0.1 mol | D.无法判断 |
 ,写出该反应的化学方程式:
,写出该反应的化学方程式:I.亚硝酸钠的制备
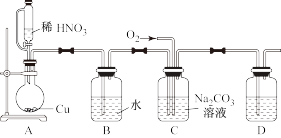
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为
II.探究亚硝酸钠与硫酸反应气体产物成分。
已知:①NO+NO2+2OH-═2
 +H2O②气体液化的温度:NO2:21℃,NO:-152℃
+H2O②气体液化的温度:NO2:21℃,NO:-152℃
(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A→C→
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是
②装置B的作用是
5 . 碳酸铈[Ce2(CO3)3]是制备稀土发光材料、汽车尾气净化催化剂的重要原料。碳酸铈可由铈的氯化物和碳酸氢铵反应制备。甲同学利用下列装置模拟制备Ce2(CO3)3:

已知:i.装置C中溶液为亚硫酸钠溶液;
ii.Ksp[Ce2(CO3)3]=1.00×10-28;
iii.Ce3+易被空气氧化成Ce4+。
(1)装置D中盛放稀盐酸的实验仪器名称为
(2)装置A中发生的化学反应方程式为
(3)实验装置中有一处不合理,请针对不合理之处写出改进措施:
(4)装置B中制备Ce2(CO3)3反应的离子方程式为
(5)实验过程中当Ce3+沉淀完全时 ,溶液中
,溶液中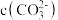 为
为
(6)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到产品。检验产品是否洗涤干净的方法为
(7)为测定产品中Ce2(CO3)3的纯度,取 产品加入稀硫酸、
产品加入稀硫酸、 溶液至全部溶解,配成
溶液至全部溶解,配成 溶液,取
溶液,取 溶液用
溶液用 的
的 溶液滴定至终点(铈被还原成Ce3+),消耗
溶液滴定至终点(铈被还原成Ce3+),消耗 溶液
溶液 ,则产品中Ce2(CO3)3的纯度为
,则产品中Ce2(CO3)3的纯度为
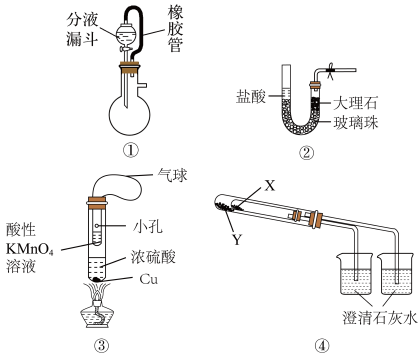
| A.装置①中分液漏斗内的液体可顺利加入蒸馏烧瓶 |
| B.装置②可实现制取CO2实验中的“即关即止,即开即用”的作用 |
| C.利用装置③制取SO2,并验证其还原性 |
| D.利用装置④验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3 |



