解题方法
1 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
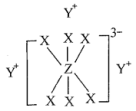
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出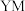 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓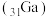 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓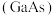 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性: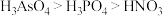
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
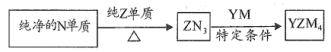
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
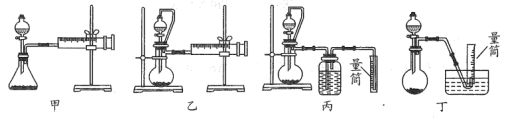
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品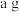 ,若实验测得氢气的体积为
,若实验测得氢气的体积为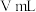 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示: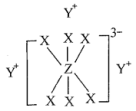
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
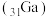 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓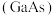 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:
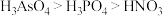
②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
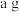 ,若实验测得氢气的体积为
,若实验测得氢气的体积为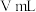 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
名校
2 . 工业上用废料制备 的工艺流程如图所示:
的工艺流程如图所示:
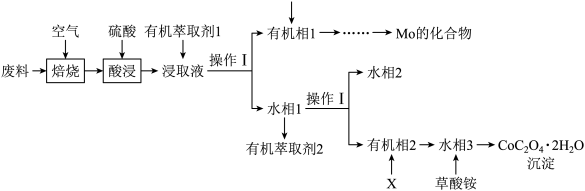
已知:①废料中主要含有 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;
②焙烧时,Mo元素转化为 ;
;
③浸取液中金属离子以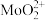 、
、 、
、 形式存在;
形式存在;
④25℃时,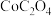 的
的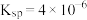 。
。
回答下列问题:
(1)Co元素在元素周期表中的位置是___________ 。已知Mo的核电荷数为42,Mo(IV)离子的价层电子排布式是___________ 。
(2)焙烧时,发生氧化反应的元素有___________ (填元素符号)。标准状况下33.6L 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为___________ 。
(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为___________ 。
(4)在实验室进行操作I,所用到的玻璃仪器有___________ 。
(5)萃取 “的原理是“
“的原理是“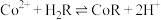 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有___________ ,加入试剂X是___________ (填名称),假定水相3中 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中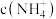 最小值的计算式为
最小值的计算式为___________ mol/L(用含c的计算式表示)。
(6)在空气中加热10.98g ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为___________ 。
 的工艺流程如图所示:
的工艺流程如图所示:
已知:①废料中主要含有
 、
、 、
、 ,其他杂质不参与反应;
,其他杂质不参与反应;②焙烧时,Mo元素转化为
 ;
;③浸取液中金属离子以
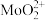 、
、 、
、 形式存在;
形式存在;④25℃时,
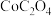 的
的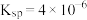 。
。回答下列问题:
(1)Co元素在元素周期表中的位置是
(2)焙烧时,发生氧化反应的元素有
 参与焙烧,完全反应时转移的电子的物质的量为
参与焙烧,完全反应时转移的电子的物质的量为(3)酸浸时,所用硫酸过量,则Mo元素发生转化的离子方程式为
(4)在实验室进行操作I,所用到的玻璃仪器有
(5)萃取
 “的原理是“
“的原理是“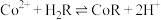 ”,水相2中存在的主要阳离子有
”,水相2中存在的主要阳离子有 的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当
的浓度为c mo/L,且沉钴过程中加入沉淀剂固体后不考虑溶液体积变化,并忽略盐类的水解,当 沉淀完全时,溶液中
沉淀完全时,溶液中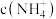 最小值的计算式为
最小值的计算式为(6)在空气中加热10.98g
 ,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有
,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。经测定,加热到210~320℃过程中的生成物只有 和钴的氧化物,此过程发生反应的化学方程式为
和钴的氧化物,此过程发生反应的化学方程式为| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 210~320 | 4.82 |
| 890~920 | 4.50 |
您最近一年使用:0次
2022-09-25更新
|
403次组卷
|
2卷引用:重庆市巴蜀中学校2022-2023学年高三上学期适应性月考卷(二)化学试题
3 . Ⅰ.由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90 nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为_______ 。
(2)“滤渣”中的主要成分是_______ 。
(3)流程中“ ”环节的目的是
”环节的目的是_______ 。
(4)“还原”过程中涉及的离子方程式为_______ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_______ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47 g透明氧化铁,用稀硫酸溶解并定容至1 L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为_______ %(保留小数点后一位)。
Ⅱ.重晶石(BaSO4)作为原料制备金属钡及其他含钡化合物的方法如下图:

完成下列填空:
(7)Ba在元素周期表中的位置为_______ ,最外层电子的电子云形状是_______ 。图中涉及的第二周期元素电负性由大到小的顺序是_______ (用元素符号表示),可以判断其中两种元素非金属性强弱的反应是_______ (选填流程中的反应编号)。
(8)配平BaS与稀硝酸反应的化学方程式:_______
_______BaS+_______HNO3=_______Ba(NO3)2+_______S+_______NO↑+_______H2O

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90 nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47 g透明氧化铁,用稀硫酸溶解并定容至1 L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为
Ⅱ.重晶石(BaSO4)作为原料制备金属钡及其他含钡化合物的方法如下图:

完成下列填空:
(7)Ba在元素周期表中的位置为
(8)配平BaS与稀硝酸反应的化学方程式:
_______BaS+_______HNO3=_______Ba(NO3)2+_______S+_______NO↑+_______H2O
您最近一年使用:0次
名校
解题方法
4 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:
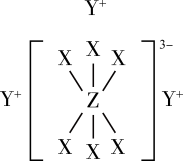
回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:___________ 。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为___________ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示: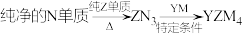 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
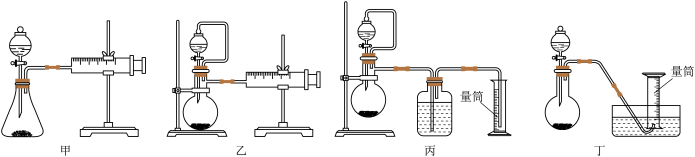
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为___________ (用代数式表示)。

回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示:
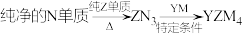 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为
您最近一年使用:0次
名校
5 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是____ ,用电子式表示Y的最高价氧化物的形成过程:_____ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)_______ 。
(3)在 与
与 的混合液中通入足量
的混合液中通入足量 ,是工业制取
,是工业制取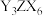 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
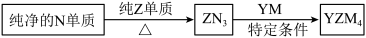
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品ag,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)
(3)在
 与
与 的混合液中通入足量
的混合液中通入足量 ,是工业制取
,是工业制取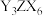 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为
 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
6 . 亚硒酸钠(Na2SeO3)为无色晶体,在空气中稳定,溶于水不溶于醇。如图是氧气氧化法制备亚硒酸钠的生产工序,请回答下列问题∶

(1)硒与硫是同主族的相邻元素,亚硒酸钠中硒的化合价为_________ ,在周期表中的位置是_________ 。
(2)搅拌槽中加入氢氧化钠合成亚硒酸钠溶液并调整pH值为7~14,pH值调到7~ 14的原因是____________ 。
(3)操作①的名称是_______ ;流程图中真空干燥箱的作用是_____________ 。
(4)操作②为_____________ 、结晶、过滤、洗涤,然后用离心机甩掉结晶残液即得带有结晶水的亚硒酸钠。其中所用洗涤剂最好是______ (填序号)。
a.稀硫酸b.氢氧化钠稀溶液c.水d.乙醇
(5)现在常用以单质硒为原料,在氢氧化钠水溶液中通入高压氧气的方法来获得亚硒酸钠。写出制备亚硒酸钠的化学反应方程式:____________________ 。
(6)已知在上述合成路线中粗硒在转化为二氧化硒时损失2%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产______ t(精确到0.1t)含亚硒酸钠95%的产品。

(1)硒与硫是同主族的相邻元素,亚硒酸钠中硒的化合价为
(2)搅拌槽中加入氢氧化钠合成亚硒酸钠溶液并调整pH值为7~14,pH值调到7~ 14的原因是
(3)操作①的名称是
(4)操作②为
a.稀硫酸b.氢氧化钠稀溶液c.水d.乙醇
(5)现在常用以单质硒为原料,在氢氧化钠水溶液中通入高压氧气的方法来获得亚硒酸钠。写出制备亚硒酸钠的化学反应方程式:
(6)已知在上述合成路线中粗硒在转化为二氧化硒时损失2%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产
您最近一年使用:0次



