名校
解题方法
1 .  (草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。
(草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。
(一)乙炔的制备

已知:电石的主要成分是 ,还有少量的CaS、
,还有少量的CaS、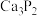 。
。
(1)用饱和食盐水代替水的目的是___________ 。
(2)装置B中 溶液的作用是
溶液的作用是___________ 。
(3)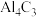 常用作甲烷发生剂,根据
常用作甲烷发生剂,根据 和饱和食盐水制取
和饱和食盐水制取 的原理,写出
的原理,写出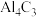 与饱和食盐水反应的化学方程式:
与饱和食盐水反应的化学方程式:___________ 。
(二)草酸的制备
(4) 通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为
通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为___________ ,研究表明当硝酸的质量分数超过50%或温度高于40℃,草酸的产率开始下降,其原因是___________ 。

(5)装置G的作用是___________ 。
(三)草酸纯度的测定
步骤1.称取15.0g草酸样品,配制成100mL溶液。
步骤2.量取25mL所配制的溶液于锥形瓶中,加入 酸性
酸性 溶液充分反应。
溶液充分反应。
步骤3.向反应后的溶液中加入 溶液至溶液中紫红色褪去,消耗
溶液至溶液中紫红色褪去,消耗 溶液体积为
溶液体积为 。
。
(6)上述过程中发生反应的离子方程式为___________ 。
(7)原试样中草酸的质量分数为___________ (列式即可,不用化简)。
 (草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。
(草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。(一)乙炔的制备

已知:电石的主要成分是
 ,还有少量的CaS、
,还有少量的CaS、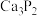 。
。(1)用饱和食盐水代替水的目的是
(2)装置B中
 溶液的作用是
溶液的作用是(3)
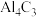 常用作甲烷发生剂,根据
常用作甲烷发生剂,根据 和饱和食盐水制取
和饱和食盐水制取 的原理,写出
的原理,写出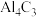 与饱和食盐水反应的化学方程式:
与饱和食盐水反应的化学方程式:(二)草酸的制备
(4)
 通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为
通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为
(5)装置G的作用是
(三)草酸纯度的测定
步骤1.称取15.0g草酸样品,配制成100mL溶液。
步骤2.量取25mL所配制的溶液于锥形瓶中,加入
 酸性
酸性 溶液充分反应。
溶液充分反应。步骤3.向反应后的溶液中加入
 溶液至溶液中紫红色褪去,消耗
溶液至溶液中紫红色褪去,消耗 溶液体积为
溶液体积为 。
。(6)上述过程中发生反应的离子方程式为
(7)原试样中草酸的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:
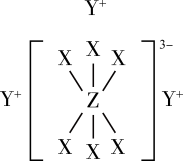
回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:___________ 。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为___________ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示: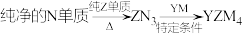 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
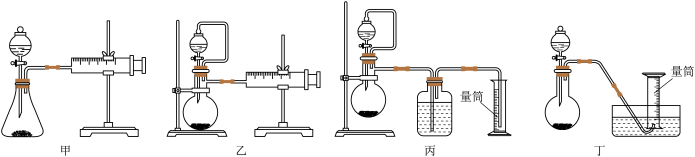
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为___________ (用代数式表示)。

回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示:
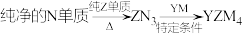 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为
您最近一年使用:0次
名校
解题方法
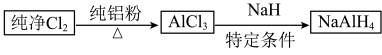
3 . 铝氢化钠( )是有机合成的重要还原剂,其合成路线如下:
)是有机合成的重要还原剂,其合成路线如下:
(1)已知 的熔点为190℃,沸点为178℃,在潮湿的空气中易水解。某实验小组利用下图中的装置制备无水
的熔点为190℃,沸点为178℃,在潮湿的空气中易水解。某实验小组利用下图中的装置制备无水 (部分夹持装置略去)。
(部分夹持装置略去)。
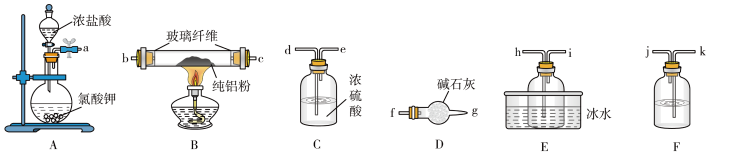
①圆底烧瓶中发生反应的化学方程式为___________ 。
②按气流方向连接各仪器接口,顺序为a→___________ (填接口字母)。
③装置A盛放浓盐酸的仪器名称为___________ ,装置D的作用是___________ 。
(2) 与NaH反应时,需先将
与NaH反应时,需先将 溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是
溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是___________ 。
(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化钠与水反应的化学方程式为___________ 。
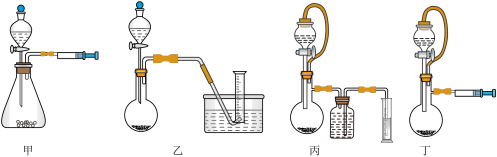
②设计如下四种装置(部分夹持装置略去)测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是___________ (填编号)。
 )是有机合成的重要还原剂,其合成路线如下:
)是有机合成的重要还原剂,其合成路线如下:
(1)已知
 的熔点为190℃,沸点为178℃,在潮湿的空气中易水解。某实验小组利用下图中的装置制备无水
的熔点为190℃,沸点为178℃,在潮湿的空气中易水解。某实验小组利用下图中的装置制备无水 (部分夹持装置略去)。
(部分夹持装置略去)。
①圆底烧瓶中发生反应的化学方程式为
②按气流方向连接各仪器接口,顺序为a→
③装置A盛放浓盐酸的仪器名称为
(2)
 与NaH反应时,需先将
与NaH反应时,需先将 溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是
溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化钠与水反应的化学方程式为
②设计如下四种装置(部分夹持装置略去)测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是

您最近一年使用:0次
解题方法
4 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
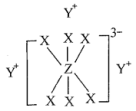
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
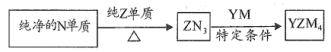
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
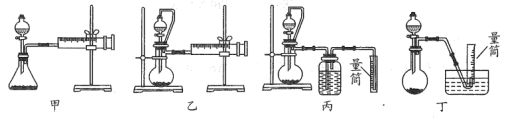
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示: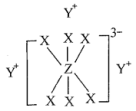
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是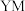 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓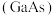 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
名校
5 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是____ ,用电子式表示Y的最高价氧化物的形成过程:_____ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)_______ 。
(3)在 与
与 的混合液中通入足量
的混合液中通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
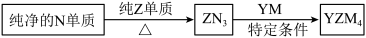
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品ag,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)
(3)在
 与
与 的混合液中通入足量
的混合液中通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为
 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
6 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y 、Z简单离子的核外电子排布相同,物质A的结构式如右图所示,回答下列问题:

(1)上述元素中,最高化合价数值最大的是___________ (用元素符号表示)。
(2)Y的离子结构示意图是___________ ; 其氢化物的电子式为___________ 。
(3)N、X、Y、Z简单离子的半径由大到小的顺序为___________ (用对应离子符号表示)。
(4)上述元素形成的化合物中,能腐蚀玻璃的是___________ (填化学式);生活中可用Z的单质与Y的最高价氧化物对应水化合物的反应疏通下水道,其反应的离子方程式为___________ ,该反应的还原剂与氧化剂的物质的量之比为___________ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示
纯净的N单质 ZN3
ZN3 YZM4
YZM4
实验室利用YZM4遇水反应生成的氢的体积测定YZM4样品纯度。
①该反应的化学方程式___________ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是___________ (填编号)。

(1)上述元素中,最高化合价数值最大的是
(2)Y的离子结构示意图是
(3)N、X、Y、Z简单离子的半径由大到小的顺序为
(4)上述元素形成的化合物中,能腐蚀玻璃的是
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示
纯净的N单质
 ZN3
ZN3 YZM4
YZM4实验室利用YZM4遇水反应生成的氢的体积测定YZM4样品纯度。
①该反应的化学方程式
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
您最近一年使用:0次
2021-11-21更新
|
360次组卷
|
3卷引用:山东省泰安市2021-2022年高三上学期期中统考化学试题
山东省泰安市2021-2022年高三上学期期中统考化学试题山东省泰安市2022届高三上学期期中考试化学试题(已下线)解密05 物质结构 元素周期律(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
名校
7 . 铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成路线如图所示。
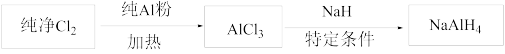
(1)已知AlCl3的熔点为190℃,沸点为178℃,在湖湿的空气中易水解。某实验小组利用下图中装置制备无水AlCl3。
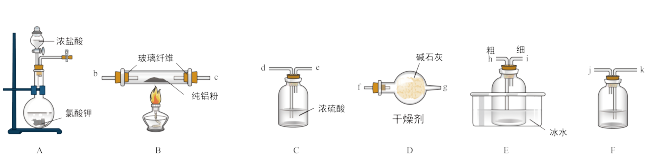
①写出圆底烧瓶中发生反应的离子方程式:___________ 。
②按气流方向连接各仪器接口,顺序为a→___________ b→c→___________ 。(填接口字母)
③装置F中应盛装的试剂是___________ ,装置D的作用是___________ 。
(2)AlCl3与NaH反应时,需先将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是___________ 。
(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化钠与水反应的化学方程式为___________ 。
②设计如下四种装置测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是___________ (填编号)。
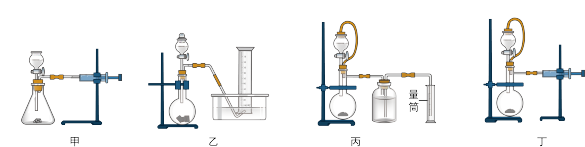
③某同学选用上述最恰当的装置,称取mg铝氢化钠样品,重复实验操作三次,测得生成气体的平均体积为VL(已折算为标准状况),则样品中铝氢化钠的纯度为___________ 。(用含m、V的式子表示)
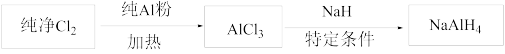
(1)已知AlCl3的熔点为190℃,沸点为178℃,在湖湿的空气中易水解。某实验小组利用下图中装置制备无水AlCl3。

①写出圆底烧瓶中发生反应的离子方程式:
②按气流方向连接各仪器接口,顺序为a→
③装置F中应盛装的试剂是
(2)AlCl3与NaH反应时,需先将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是
(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化钠与水反应的化学方程式为
②设计如下四种装置测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是

③某同学选用上述最恰当的装置,称取mg铝氢化钠样品,重复实验操作三次,测得生成气体的平均体积为VL(已折算为标准状况),则样品中铝氢化钠的纯度为
您最近一年使用:0次
名校
8 . 某化学兴趣小组查阅文献资料了解到湿法合成高铁酸钾(K2FeO4)是目前人工成本最低、产品纯度最高的合成方法,其合成路线如图:
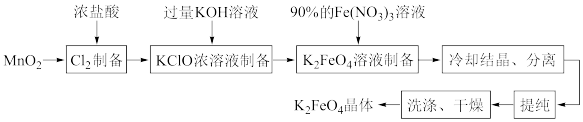
该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取K2FeO4。
已知:K2FeO4为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。
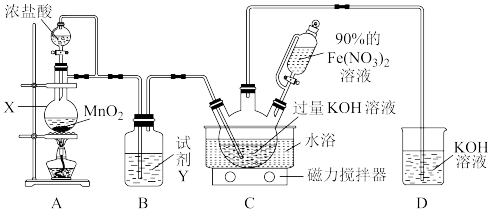
(1)仪器X的名称是_______ 。试剂Y的作用为_______ 。
(2)水浴方式是_______ (填“冷水浴”或“热水浴”)。
(3)装置C中KOH过量的原因是_______ 。
(4)上述流程中,“提纯”所用的方法是_______ 。
(5)称取1.98 g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{K[Cr(OH)4]}反应后配成100.00 mL溶液;取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1 mL苯二胺磺酸钠作指示剂,用1.00 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,消耗(NH4)2Fe(SO4)2溶液5.76 mL。测定过程中发生反应:
a. Cr(OH) +FeO
+FeO =Fe(OH)3+CrO
=Fe(OH)3+CrO +OH-
+OH-
b. 2CrO +2H+=Cr2O
+2H+=Cr2O +H2O
+H2O
c. Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
则K2FeO4样品的纯度是_______ 。
(6)K2FeO4是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释K2FeO4作为多功能水处理剂的原理:_______ 。
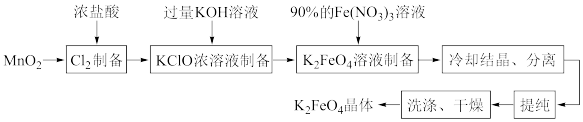
该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取K2FeO4。
已知:K2FeO4为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。

(1)仪器X的名称是
(2)水浴方式是
(3)装置C中KOH过量的原因是
(4)上述流程中,“提纯”所用的方法是
(5)称取1.98 g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{K[Cr(OH)4]}反应后配成100.00 mL溶液;取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1 mL苯二胺磺酸钠作指示剂,用1.00 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,消耗(NH4)2Fe(SO4)2溶液5.76 mL。测定过程中发生反应:
a. Cr(OH)
 +FeO
+FeO =Fe(OH)3+CrO
=Fe(OH)3+CrO +OH-
+OH-b. 2CrO
 +2H+=Cr2O
+2H+=Cr2O +H2O
+H2Oc. Cr2O
 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O则K2FeO4样品的纯度是
(6)K2FeO4是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释K2FeO4作为多功能水处理剂的原理:
您最近一年使用:0次
2022-01-12更新
|
158次组卷
|
4卷引用:吉林省长春吉大附中实验学校2021-2022学年高三上学期第三次摸底考试化学试题
吉林省长春吉大附中实验学校2021-2022学年高三上学期第三次摸底考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(工业流程题)福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题(已下线)工业流程题
真题
名校
9 . 某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu(NO3)2·3H2O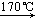 Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 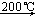 CuO
CuO
SOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是_________ (填化学式)。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____ 。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是__________ (填一种)。
(3)第④步中发生反应的化学方程式是_______________________ 。
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由___________________ 。
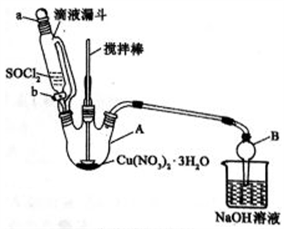
装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞____ (填“a”、“b”或“a和b”)。
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:
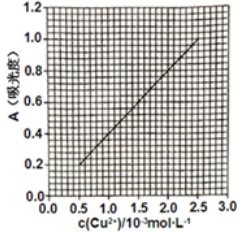
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________ (以质量分数表示)。

已知:Cu(NO3)2·3H2O
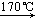 Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 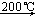 CuO
CuOSOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是
(3)第④步中发生反应的化学方程式是
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由

装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是
您最近一年使用:0次
2018-06-12更新
|
2435次组卷
|
5卷引用:2016年10月浙江省普通高校招生选考科目考试化学试题
2016年10月浙江省普通高校招生选考科目考试化学试题【全国校级联考】湖南湖北八市十二校2019届高三第一次调研联考化学试题【校级联考】陕西省咸阳市武功县2019届高三下学期第二次摸底检测理科综合化学试题(已下线)专题22.综合实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)黑龙江省哈尔滨市第三中学校2021-2022学年高三上学期第四次验收考试理科综合化学试题
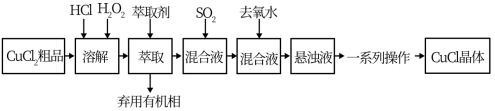
10 . 氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu2(OH)3C1],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下:
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq) [CuCl3]2-(aq)。
[CuCl3]2-(aq)。
请回答:
(1)下列叙述正确的是__________ 。
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇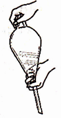
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:
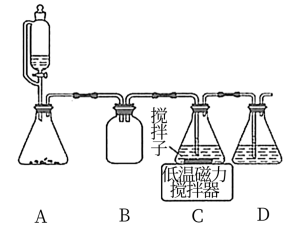
①装置D的作用是_______________ 。
②C中反应的离子方程式为_____________ 。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是________________ 。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、____________ 。
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为____________ 。
②产品中CuCl的纯度为__________ (本实验条件下,Cl-难于被MnO4-氧化)。

已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq)
 [CuCl3]2-(aq)。
[CuCl3]2-(aq)。请回答:
(1)下列叙述正确的是
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇

C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:

①装置D的作用是
②C中反应的离子方程式为
(3)上述合成路线中,向混合液中加入大量去氧水的目的是
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为
②产品中CuCl的纯度为
您最近一年使用:0次



