1 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置可重复选用)进行实验:
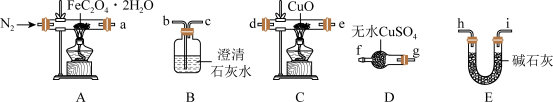
①E中盛装碱石灰的仪器名称为_________ 。
②按照气流从左到右的方向,上述装置的接口顺序为a→g→f→_____ →尾气处理装置(仪器可重复使用)。
③实验前先通入一段时间N2,其目的为__________________ 。
④实验证明了气体产物中含有CO,依据的实验现象为_____________ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为____________________ 。
(3)晒制蓝图时,以K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为______________ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀HSO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 cmol/L KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用 cmol/L KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为______________ ;步骤3中加入锌粉的目的为_______ 。
(5)草酸亚铁晶体样品的纯度为________ ;若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将____ (填“偏高”、“偏低”或“不变”)。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为
②按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
③实验前先通入一段时间N2,其目的为
④实验证明了气体产物中含有CO,依据的实验现象为
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,以K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀HSO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 cmol/L KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用 cmol/L KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)草酸亚铁晶体样品的纯度为
您最近一年使用:0次
2019-03-16更新
|
649次组卷
|
3卷引用:【全国百强校】四川省成都七中2019届高三下学期二诊模拟考试化学试题
2 . 从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解, | 证明Na2SO3已氧化变质 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A.②⑤ | B.④⑤ | C.①② | D.全部 |
您最近一年使用:0次
2019-09-28更新
|
316次组卷
|
10卷引用:2017届山东师大附中高三上学期第一次模拟化学试卷
2017届山东师大附中高三上学期第一次模拟化学试卷2017届湖南省雅礼中学高三上月考二化学试卷2017届山东省莱芜一中高三上学期10月月考化学试卷(已下线)2019年4月20日 《每日一题》 三轮复习-周末培优山东师范大学附中2020届高三第一次月考化学试题山东师范大学附属中学2020届高三开学考试检测化学试题山东省淄博市第七中学2019-2020学年高三上学期第一次月考化学试题2020届高考化学小题狂练(全国通用版)专练7 非金属及其化合物山东省济宁市曲阜市第一中学2020-2021学年高一4月月考化学试题(已下线)【浙江新东方】高中化学20210513-046【2021】【高一下】
3 . 用莫尔盐[(NH4)2Fe(SO4)2·6H2O]为浅绿色晶体,隔绝空气时遇强热可完全分解为一种固体产物和多种气体产物(已知产物中无O2,其中确定的成分之一为N2)。在定量分析中莫尔盐常用作标定高锰酸钾、重铬酸钾等溶液的标准物质。回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,可用来检验莫尔盐是否变质的试剂是_________ 。
(2)莫尔盐标定高锰酸钾溶液时,准确移取KMnO4溶液的仪器名称是_________ ,滴定过程中反应的离子方程式为________________________ 。
(3)某课题组组装如图所示的装置,通过实验检验莫尔盐晶体遇强热时的分解产物。实验中可观察到A中绿色粉末逐渐变成红色粉末,据此推测分解产物中有_________ (填化学式),同时装置C中酚酞溶液变红,酚酞溶液的作用是__________________ 。该装置可能存在的缺点是____________________________________ 。
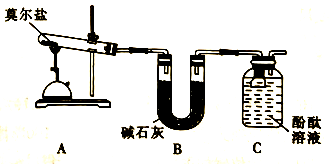 ,
,
(4)为分别检验产物中SO3(g)和SO2(g)的存在,应选用的试剂为_________ 和_________ 。加入试剂后经检验产物中不存在SO3(g),据此写出莫尔盐遇强热分解的化学方程式:_____________________________________________ 。
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,可用来检验莫尔盐是否变质的试剂是
(2)莫尔盐标定高锰酸钾溶液时,准确移取KMnO4溶液的仪器名称是
(3)某课题组组装如图所示的装置,通过实验检验莫尔盐晶体遇强热时的分解产物。实验中可观察到A中绿色粉末逐渐变成红色粉末,据此推测分解产物中有
 ,
,(4)为分别检验产物中SO3(g)和SO2(g)的存在,应选用的试剂为
您最近一年使用:0次
名校
解题方法
4 . FeSO4·7H2O 广泛用于医药和工业领域。下面是以工业废铁屑为原料生产FeSO4·7H2O 的流程图。

(1)加适量碳酸钠溶液的目的是___________ ,反应Ⅰ需要加热数分钟,其原因是___________ 。
(2)判断反应Ⅱ完成的现象是___________ 。反应Ⅱ需要 100mL1mol/L 的稀硫酸,用 98.3%,ρ=1.84g/cm3 的浓硫酸配制。所用的仪器除量筒、烧杯、玻璃棒外,还需要玻璃仪器___________ 。
(3)测定 FeSO4·7H2O 产品中 Fe2+含量的方法是用 KMnO4溶液滴定法(5Fe2++MnO +8H+= 5Fe3++Mn2++4H2O),步骤为:
+8H+= 5Fe3++Mn2++4H2O),步骤为:
Ⅰ.称取 2.8500g FeSO4·7H2O 产品,配制成 250mL 溶液;
Ⅱ.量取 25.00mL 待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的 0.0100moL/L KMnO4溶液滴定至终点,消耗 KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的现象是___________ ;
②计算上述样品中 FeSO4·7H2O 的质量分数为___________ (用小数表示,保留三位小数);
(4)已知 FeSO4·7H2O 晶体在加热条件下发生如下反应:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。

①仪器的连接顺序为 a___________ 。
②装置 C 中的 X 为___________ ;该装置中冷水的作用是___________ 。

(1)加适量碳酸钠溶液的目的是
(2)判断反应Ⅱ完成的现象是
(3)测定 FeSO4·7H2O 产品中 Fe2+含量的方法是用 KMnO4溶液滴定法(5Fe2++MnO
 +8H+= 5Fe3++Mn2++4H2O),步骤为:
+8H+= 5Fe3++Mn2++4H2O),步骤为:Ⅰ.称取 2.8500g FeSO4·7H2O 产品,配制成 250mL 溶液;
Ⅱ.量取 25.00mL 待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的 0.0100moL/L KMnO4溶液滴定至终点,消耗 KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的现象是
②计算上述样品中 FeSO4·7H2O 的质量分数为
(4)已知 FeSO4·7H2O 晶体在加热条件下发生如下反应:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
①仪器的连接顺序为 a
②装置 C 中的 X 为
您最近一年使用:0次
5 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
I.测定绿矾中结晶水含量
为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
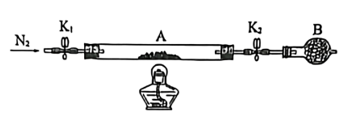
(1)将下列实验操作步骤正确排序________→________→________→________→c→e(填字母)______ ;重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
(2)根据实验记录,计算绿矾化学式中结晶水数目x=______ (列式表示)。
II.探究绿矾的热分解产物
该小组用如图所示装置进行实验(夹持仪器略)。
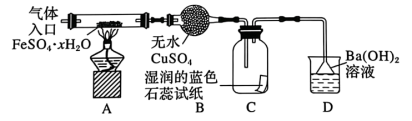
(3)在实验过程中,观察到A中固体变红棕色,B中的现象:______ ;C中试纸的颜色变化是_____ 。
(4)D中有白色沉淀生成,该沉淀的化学式为______ 。有同学认为还应该增加一个实验,取D中沉淀,加入一定量的盐酸以确定其组成,从而确定FeSO4·xH2O的分解产物,你认为是否必要?______ (填“是”或者“否”)请说明你的理由:______ 。
III.测定绿矾热分解时的温度与剩余固体质量关系
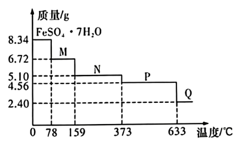
(5)将8.34gFeSO4∙7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。已知M(FeSO4∙7H2O)=278g∙mol-1,在100℃时,M的化学式为______ 。
I.测定绿矾中结晶水含量
为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

(1)将下列实验操作步骤正确排序________→________→________→________→c→e(填字母)
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
(2)根据实验记录,计算绿矾化学式中结晶水数目x=
II.探究绿矾的热分解产物
该小组用如图所示装置进行实验(夹持仪器略)。

(3)在实验过程中,观察到A中固体变红棕色,B中的现象:
(4)D中有白色沉淀生成,该沉淀的化学式为
III.测定绿矾热分解时的温度与剩余固体质量关系
(5)将8.34gFeSO4∙7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。已知M(FeSO4∙7H2O)=278g∙mol-1,在100℃时,M的化学式为

您最近一年使用:0次
名校
6 . 草酸亚铁晶体(FeC2O4∙2H2O)是一种浅黄色固体,是生产锂电池的原材料,也常用作分析试剂、显影剂及制药工业。它难溶于水,不溶于丙酮,熔点为160℃,受热易分解。回答下列问题:
(1)制备草酸亚铁晶体:称取10g(NH4)2Fe(SO4)2∙6H2O于200mL烧杯中,加入适量蒸馏水溶解,再加入8mL饱和H2C2O4溶液,继续滴加5滴2 硫酸酸化,不断搅拌,加热至沸腾,待有浅黄色固体析出时,静置,抽滤,洗涤,晾干。
硫酸酸化,不断搅拌,加热至沸腾,待有浅黄色固体析出时,静置,抽滤,洗涤,晾干。
①不断搅拌的作用是_______ 。
②制备草酸亚铁的化学方程式为_______ 。
③洗涤草酸亚铁晶体时,先用水洗,再用丙酮洗涤2~3次,原因是_______ 。
(2)查阅资料获知:草酸亚铁晶体在600℃左右发生分解反应,产物中有H2O、CO、CO2三种气体,某化学兴趣小组拟利用如图装置验证草酸亚铁晶体受热分解的气体产物。

实验时,合理的装置(可重复选择)连接顺序是A→_______ →尾气吸收。
(3)工业中制得的草酸亚铁晶体(FeC2O4·2H2O)中常有FeSO4杂质,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品溶于稀硫酸中配成250mL溶液,取25mL溶液滴定,消耗c1 mol/L高锰酸钾溶液V1mL
Ⅱ.向反应后溶液加入锌粉,酸化,消耗c1 mol/L高锰酸钾溶液V2mL
①滴定时应将高锰酸钾溶液加入_______ (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若起始读数为15.00mL,此时滴定管中溶液实际体积_______ (填大于,小于或等于)35.00mL
②第二次达到滴定终点的现象是_______
③该样品的纯度为_______ ;若配制溶液时亚铁离子被氧化,则测定结果将_______ (填“偏高”“偏低”或“不变”)
(1)制备草酸亚铁晶体:称取10g(NH4)2Fe(SO4)2∙6H2O于200mL烧杯中,加入适量蒸馏水溶解,再加入8mL饱和H2C2O4溶液,继续滴加5滴2
 硫酸酸化,不断搅拌,加热至沸腾,待有浅黄色固体析出时,静置,抽滤,洗涤,晾干。
硫酸酸化,不断搅拌,加热至沸腾,待有浅黄色固体析出时,静置,抽滤,洗涤,晾干。①不断搅拌的作用是
②制备草酸亚铁的化学方程式为
③洗涤草酸亚铁晶体时,先用水洗,再用丙酮洗涤2~3次,原因是
(2)查阅资料获知:草酸亚铁晶体在600℃左右发生分解反应,产物中有H2O、CO、CO2三种气体,某化学兴趣小组拟利用如图装置验证草酸亚铁晶体受热分解的气体产物。

实验时,合理的装置(可重复选择)连接顺序是A→
(3)工业中制得的草酸亚铁晶体(FeC2O4·2H2O)中常有FeSO4杂质,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品溶于稀硫酸中配成250mL溶液,取25mL溶液滴定,消耗c1 mol/L高锰酸钾溶液V1mL
Ⅱ.向反应后溶液加入锌粉,酸化,消耗c1 mol/L高锰酸钾溶液V2mL
①滴定时应将高锰酸钾溶液加入
②第二次达到滴定终点的现象是
③该样品的纯度为
您最近一年使用:0次
7 . 蛋白质是生命的物质基础。某学习小组实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是_______ 。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。
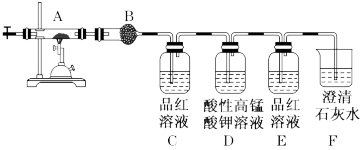
①装置B中的试剂是_______ 。
②装置D的作用是_______ 。
③当装置B、C、E、F依次出现下列现象:_______ ,品红溶液褪色,_______ ,出现白色浑浊;可证明燃烧产物中含有H2O,SO2>CO2,结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2 +I2=
+I2= +2I-
+2I-
(3)写出二氧化硫与碘水反应的化学方程式:_______ 。
(4)滴定终点的现象为_______ 。
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为_______ 。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值_______ (填“偏大*偏小”或“无影响”)。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是
②装置D的作用是
③当装置B、C、E、F依次出现下列现象:
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2
 +I2=
+I2= +2I-
+2I-(3)写出二氧化硫与碘水反应的化学方程式:
(4)滴定终点的现象为
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
8 . 某草酸钙晶体(CaC2O4·xH2O)热分解研究
(提示:CaC2O4·xH2O受热会失去结晶水成为CaC2O4;白色硫酸铜粉末遇水会变蓝。)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
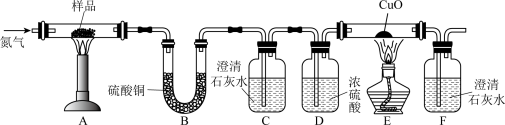
(1)①反应开始前通入氮气的目的是___________ ,装置C的作用是___________ 。
②装置B中硫酸铜粉末变蓝,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物有___________ ,经检验A中残留固体为氧化物。
③对上述装置从环保角度提一个改进建议___________ 。
(2)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,
获得相关数据,绘制成固体质量—分解温度的关系如图。

①800℃以上时,固体成分的化学式为___________ 。
②残留固体为CaC2O4时的温度范围___________ 。
③写出固体质量由12.8 g变为10.0 g时的化学方程式___________ 。
(提示:CaC2O4·xH2O受热会失去结晶水成为CaC2O4;白色硫酸铜粉末遇水会变蓝。)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)

(1)①反应开始前通入氮气的目的是
②装置B中硫酸铜粉末变蓝,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物有
③对上述装置从环保角度提一个改进建议
(2)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,
获得相关数据,绘制成固体质量—分解温度的关系如图。

①800℃以上时,固体成分的化学式为
②残留固体为CaC2O4时的温度范围
③写出固体质量由12.8 g变为10.0 g时的化学方程式
您最近一年使用:0次
9 .  (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
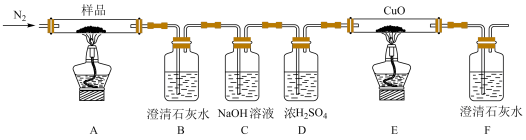
(1)通入氮气的目的是__________________________________________ 。
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____________ 、____________ 。
(3)为防止倒吸,停止实验时应进行的操作是__________________________________________ 。
(4)样品完全分解后,装置A中的残留物含有FeO和 ,检验
,检验 存在的方法是:
存在的方法是:___________________________________________________ 。
 (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
(1)通入氮气的目的是
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
(3)为防止倒吸,停止实验时应进行的操作是
(4)样品完全分解后,装置A中的残留物含有FeO和
 ,检验
,检验 存在的方法是:
存在的方法是:
您最近一年使用:0次
2020-09-15更新
|
527次组卷
|
5卷引用:专题讲座(九) 化学实验中规范答题(精讲)-2022年一轮复习讲练测
(已下线)专题讲座(九) 化学实验中规范答题(精讲)-2022年一轮复习讲练测(已下线)第3讲 铁盐及其亚铁盐鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物
10 . 某学习小组设计如图装置,验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物并测定CuFeS2的纯度(杂质不参与反应)。

回答下列问题。
(1)仪器a的名称___ ,碱石灰的作用___ 。
(2)为检验灼烧黄铜矿产生的气体,B中可选___ (填字母)
a.HNO3溶液 b.品红溶液 c.BaCl2溶液 d.溴水 e.KMnO4溶液
(3)C中NaOH的作用__ 。
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀H2SO4反应生成Cu和CuSO4。
①请设计实验验证泡铜中含有Cu2O__ 。
②用泡铜与CO反应来制取粗铜装置如图,实验时依次进行的操作:
组装仪器→检查装置气密性→加装药品→__ →__ →…→尾气处理;CO还原Cu2O的化学方程式__ 。
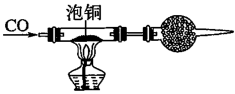

回答下列问题。
(1)仪器a的名称
(2)为检验灼烧黄铜矿产生的气体,B中可选
a.HNO3溶液 b.品红溶液 c.BaCl2溶液 d.溴水 e.KMnO4溶液
(3)C中NaOH的作用
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀H2SO4反应生成Cu和CuSO4。
①请设计实验验证泡铜中含有Cu2O
②用泡铜与CO反应来制取粗铜装置如图,实验时依次进行的操作:
组装仪器→检查装置气密性→加装药品→

您最近一年使用:0次



