名校
1 . 检验某晶体是铵盐时,将待测物取出少量放在试管中后
| A.加烧碱溶液,加热,用湿润红色石蕊试纸在管口检验 |
| B.直接加热,用湿润红色石蕊试纸在管口检验 |
| C.加烧碱溶液,加热,向试管中滴加紫色石蕊试液 |
| D.加水溶解,滴加无色酚酞试液,观察是否变红 |
您最近一年使用:0次
2019-07-01更新
|
269次组卷
|
5卷引用:四川凉山州西昌天立学校2020-2021学年高一下学期第一次月化学试题
13-14高一下·安徽·期中
名校
解题方法
2 . 下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3氧化, 形成致密的氧化膜 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润 红色石蕊试纸置于试管口 | 试纸未变蓝 | 不能确定该溶液中是否含 有NH4+ |
| D | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
1076次组卷
|
5卷引用:四川省自贡市田家炳中学2021-2022学年高一下学期期中考试化学试题
四川省自贡市田家炳中学2021-2022学年高一下学期期中考试化学试题 (已下线)2013-2014学年安徽师大附中高一下学期期中考查化学试卷2016-2017学年安徽省师大附中高二上入学测试化学试卷江西省龙南中学2022-2023学年高一下学期4月期中考试化学试题江西省横峰中学2023-2024学年高一下学期期中考试化学试题
3 . 化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
| A.检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液 |
| B.为增强高锰酸钾的氧化能力,向高锰酸钾溶液中加入稀硝酸酸化 |
| C.检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液 |
| D.检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液 |
您最近一年使用:0次
4 . 下列有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| C | 将某气体通入溴水中,溴水褪色 | 该气体一定为SO2 |
| D | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 | 该物质一定是乙醛 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有 |
| B | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
2464次组卷
|
51卷引用:四川省遂宁二中2020届高三上学期第二次月考化学试题
四川省遂宁二中2020届高三上学期第二次月考化学试题2011年普通高等学校招生全国统一考试化学卷(天津)(已下线)2011—2012学年湖北省孝感高中高一下学期期中考试化学试卷(已下线)2014届北京市重点中学高三上学期第一次月考化学试卷(已下线)2014届河南省南阳市五校联谊高三上学期期中考试化学试卷2015届福建省莆田八中高三第一次月考化学试卷2015届山东省济宁市汶上县五中高三第二次模拟化学试卷2015-2016学年湖北省沙市中学高一下第二次半月考化学卷2015-2016学年河北省武邑中学高一下学期周考化学试卷2015-2016学年山西省重点中学协作体高二下学期第一次联考化学试卷2016届内蒙古集宁一中高三上第一次月考化学试卷2016-2017学年湖北省随州一中高一上10月月考化学试卷2017届内蒙古赤峰二中高三上第二次月考化学试卷2017届甘肃省会宁一中高三上月考三化学试卷12017届甘肃省会宁一中高三上月考三化学试卷22017届北京市密云区高三3月一模考试理综化学试卷云南省大理州南涧彝族自治县民族中学2016-2017学年高一下学期6月月考化学试题山西省忻州市第一中学2016-2017学年高一上学期期末复习化学试题河南省林州市第一中学2017-2018学年高二上学期开学考试化学试题天津市南开中学2018届高三上学期第一次月考化学试题天津市南开中学2018届高三10月月考化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一3月月考化学试题(已下线)《考前20天终极攻略》-5月21日 基础实验【全国百强校】河北省辛集中学2017-2018学年高二6月月考化学试题甘肃省酒泉市敦煌中学2019届高三一诊化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】山西省临猗县临晋中学2019届高三9月月考化学试题山东省临沂市兴华学校2019届高三上学期9月月考化学试题【全国百强校】湖南省长沙市第一中学2018-2019学年高一上学期第一次月考化学试题安徽省定远重点中学2019届高三上学期第一次月考化学试题【校级联考】天津市静海区2019届高三上学期三校联考化学试题(已下线)2019年11月12日 《每日一题》2020年高考化学一轮复习——物质的检验与鉴别(已下线)专题10.2 物质的分离、提纯、检验与鉴别(讲)-《2020年高考一轮复习讲练测》鲁科版必修一2019—2020学年高一上学期期末考试模拟试题步步为赢 高一化学寒假作业:作业十八 综合评估(二)甘肃省临夏回族自治州永靖县移民中学2019-2020学年高三上学期期中考试化学试题新疆昌吉市教育共同体2019-2020学年高一年级上学期期末考试化学试题人教版高一化学必修1第一章《从实验学化学》测试卷甘肃省酒泉市敦煌中学2020届高三上学期第二次调研考试化学试题河北省邯郸市第一中学2019-2020学年高一下学期第一次网上月考化学试题河北省张家口市尚义县第一中学2019-2020学年高二下学期期中考试化学试题(已下线)第02讲 物质的分离和提纯(精练)——2021年高考化学一轮复习讲练测福建省莆田第七中学2021届高三上学期第一次月考化学试题吉林省洮南市第一中学2021届高三上学期期中考试化学试题安徽省淮北市树人高级中学2020-2021学年高一下学期第一次阶段考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应宁夏石嘴山第三中学2021-2022学年高二下学期期末考试化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期12月月考化学试题(已下线)专题03 离子反应方程式和离子共存(讲)-2023年高考化学二轮复习讲练测(新高考专用)山东省泰安市宁阳县2022-2023学年高三上学期11月期中考试化学试题
6 . 下列实验现象和结论相符的是
| 操作及现象 | 结论 | |
| A | 溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
| B | 某溶液中加入硝酸银,产生白色沉淀 | 溶液中一定含有Cl- |
| C | 某气体通入澄清石灰水,溶液变浑浊 | 该气体一定是CO2 |
| D | 向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-24更新
|
133次组卷
|
4卷引用:四川省宜宾县第一中学校2018-2019学年高一上学期12月份考试化学试题
7 . 下列有关离子检验的操作和实验结论都正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有NH4+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-07-08更新
|
133次组卷
|
4卷引用:四川省广安市友谊中学2018-2019学年高二上学期九月月考化学试题
名校
解题方法
8 . 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是透明、浅蓝绿色晶体,易溶于水而不溶于酒精等有机溶剂,在空气中一般比较稳定,不易被氧化。制备步骤如下:
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。
步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是_______ ,加入6 mol·L-1硫酸的作用是____________ 。
(2)向滤液中加入无水乙醇目的是_________________ 。
(3)产品中金属阳离子的检验方法及现象________________ 。
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为____________ ,制得硫酸亚铁铵样品的纯度为__________ 。
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。

步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是
(2)向滤液中加入无水乙醇目的是
(3)产品中金属阳离子的检验方法及现象
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为
您最近一年使用:0次
2017-03-15更新
|
369次组卷
|
2卷引用:四川省成都实验高级中学2019-2020学年高三12月月考理综化学试题
名校
解题方法
9 . 有一透明溶液,可能含有大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO 、CO
、CO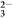 中的一种或几种,取此溶液做下列实验:
中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断:
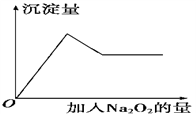
(1)溶液中一定含有的离子是______________ 。
(2)溶液中肯定不含有的离子是________________ 。
(3)可能含有的离子是____________ ,若要确定该离子的存在需要用到的实验方法是____________
 、CO
、CO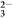 中的一种或几种,取此溶液做下列实验:
中的一种或几种,取此溶液做下列实验:①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断:

(1)溶液中一定含有的离子是
(2)溶液中肯定不含有的离子是
(3)可能含有的离子是
您最近一年使用:0次
2017-03-04更新
|
234次组卷
|
2卷引用:四川省自贡市田家炳中学2020-2021学年高一12月月考化学试题
14-15高三上·山西忻州·期中
名校
解题方法
10 . 在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是______________________ 。
(2)实验I中生成沉淀的离子方程式为________________________ 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
(4)判断K+是否存在,若存在求其最小浓度(若不存在说明理由)___________________ 。
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是
(2)实验I中生成沉淀的离子方程式为
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol·L-1 | | | | |
您最近一年使用:0次
2016-12-09更新
|
780次组卷
|
21卷引用:【全国校级联考】四川省眉山一中办学共同体2019届高三9月月考化学试题
【全国校级联考】四川省眉山一中办学共同体2019届高三9月月考化学试题(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2015-2016学年河南省南阳市宛东五校高一下第一次联考化学试卷陕西省西安中学2018届高三10月月考化学试题内蒙古巴彦淖尔市第一中学2018届高三9月月考理科综合化学试题陕西省西安中学2018届高三上学期期中考试化学试题江西省南昌市第二中学2017-2018学年高一上学期第三次月考化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题18 以离子性质为基础的无机推断题2019届高三化学一轮练习卷:离子的检验与推断(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】云南省玉溪市第一中学2019届高三上学期第二次调研考试化学试题甘肃省白银市会宁二中2019届高三上学期9月月考化学试题【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (题型专练)江西省遂川中学、吉安县中2017-2018学年高一上学期联考化学试题【全国百强校】吉林省实验中学2018-2019学年高一上学期期末考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题



