1 . 为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH 、Fe2+、SO
、Fe2+、SO 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是
 、Fe2+、SO
、Fe2+、SO 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO |
D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH |
您最近一年使用:0次
名校
解题方法
2 . 证明某溶液含有Fe2+而不含有Fe3+的实验方法是
①先加氯水,后加KSCN溶液后显红色 ②先加KSCN溶液,不显红色,再加氯水后显红色 ③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后呈红褐色 ④只滴加KSCN溶液
①先加氯水,后加KSCN溶液后显红色 ②先加KSCN溶液,不显红色,再加氯水后显红色 ③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后呈红褐色 ④只滴加KSCN溶液
| A.①② | B.②③ | C.③④ | D.①④ |
您最近一年使用:0次
2021-02-23更新
|
477次组卷
|
16卷引用:山西省康杰中学2017-2018学年高一上学期第二次月考化学试题
山西省康杰中学2017-2018学年高一上学期第二次月考化学试题宁夏育才中学2017-2018学年高一上学期期末考试化学试题天津市滨海新区大港油田一中2019届高三上学期期中考试化学试题天津市武清区杨村第三中学2018-2019学年高一上学期第三次月考化学试题河南省鹤壁市淇县第一中学2018-2019学年高一上学期第三次月考化学试题宁夏吴忠中学2019-2020学年高一上学期期末考试化学试题高一必修第一册(鲁科2019)考试帮 模块综合测评B卷人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 方法帮(已下线)第三章单元检测(测)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)第3章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)【浙江新东方】绍兴qw73湖南省常德市石门县第六中学2019-2020学年高一下学期第三次月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练天津市第三中学2020-2021学年高一上学期12月月考化学试题 甘肃兰州市第二十七中学2020-2021学年高一上学期期末考试化学试题新疆喀什地区疏附县2021-2022学年高一上学期1月测试化学试题
3 . 下列关于常见离子的检验方法和结论,其中正确的是
| A.加入AgNO3溶液,有白色沉淀生成,证明原溶液一定有Cl− |
B.先加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,证明原溶液一定有SO |
| C.先加入KSCN溶液,无现象,再加氯水后溶液变红,证明原溶液一定有Fe2+ |
| D.加入KSCN溶液变红,证明原溶液一定有Fe3+,一定没有Fe2+ |
您最近一年使用:0次
2021-01-06更新
|
178次组卷
|
3卷引用:安徽省砀山县第二中学2020-2021学年高一上学期第二次月考化学试题
名校
4 . 二氧化铈 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含 、
、 、
、 、
、 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
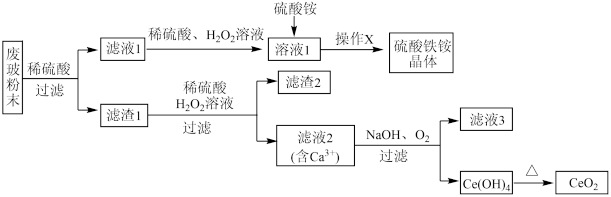
已知: 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。
回答下列问题:
(1)废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、____ ;“操作X”是将溶液1______________ 、过滤、洗涤、干燥得到硫酸铁铵晶体。
(2)向滤液1中加入稀硫酸、 溶液的目的是
溶液的目的是______ 。滤渣1中加稀硫酸和溶液发生反应的离子方程式为_____________ 。
(3)要证明滤液1中含有 ,可选用的试剂为
,可选用的试剂为_________ 。
(4)由滤液2生成 的离子方程式为
的离子方程式为__________ 。
(5)取上述流程中得到的 产品
产品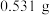 ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为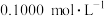 的
的 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为 ),消耗
),消耗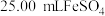 标准溶液.该产品中
标准溶液.该产品中 的质量分数为
的质量分数为______ (结果保留两位有效数字)。
 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含 、
、 、
、 、
、 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
已知:
 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。回答下列问题:
(1)废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、
(2)向滤液1中加入稀硫酸、
 溶液的目的是
溶液的目的是(3)要证明滤液1中含有
 ,可选用的试剂为
,可选用的试剂为(4)由滤液2生成
 的离子方程式为
的离子方程式为(5)取上述流程中得到的
 产品
产品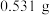 ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为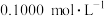 的
的 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为 ),消耗
),消耗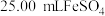 标准溶液.该产品中
标准溶液.该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-11-27更新
|
166次组卷
|
2卷引用:山东省济宁市泗水县2021届高三上学期期中考试化学试题
5 . 对下列实验过程的评价,正确的是( )
| A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
B.某溶液中滴加 BaCl2溶液,生成不溶于稀HNO3 的白色沉淀,证明一定含有 SO |
| C.某无色溶液滴入酚酞试液显红色,该溶液一定呈酸性 |
D.某溶液中加氢氧化钠溶液加热,用湿润的红色石蕊试纸靠近试管口试纸变蓝,证明一定含 NH |
您最近一年使用:0次
2020-10-19更新
|
118次组卷
|
3卷引用:山西省太原师范学院附属中学师苑中学2020-2021学年高一上学期第一次月考化学试题
山西省太原师范学院附属中学师苑中学2020-2021学年高一上学期第一次月考化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一下学期3月月考化学试题(已下线)猜想02 氮及其化合物的性质与转化(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
6 . 设计如图流程证明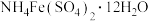 晶体的组成,下列叙述不正确的
晶体的组成,下列叙述不正确的
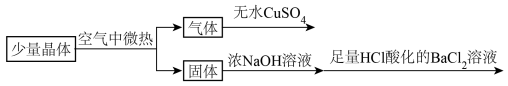
 晶体的组成,下列叙述不正确的
晶体的组成,下列叙述不正确的
| A.无水CuSO4变蓝,证明晶体中有结晶水 |
B.加入NaOH溶液,生成可以使润湿的红色石蕊试纸变蓝的气体,证明晶体中有 |
| C.加入NaOH溶液,生成红褐色沉淀,证明晶体中有Fe2+ |
D.加入HCl酸化的BaCl2溶液,生成白色沉淀,不能证明晶体中有 |
您最近一年使用:0次
2020-08-31更新
|
99次组卷
|
3卷引用:重庆市南开中学2020届高三第二次教学质量检测考试理综化学试题
名校
7 . 铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
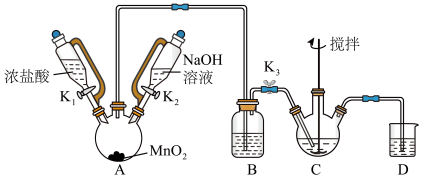
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__ 。B装置的作用是__ 。
(2)当观察到__ (填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__ ;打开__ 。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_ 。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__ 。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmol•L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__ (用含a、b、c的代数式表示)。
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:

物质 | NaBiO3 | Bi(OH)3 |
性质 | 不溶于冷水;浅黄色 | 难溶于水;白色 |
(2)当观察到
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmol•L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为
您最近一年使用:0次
2020-05-11更新
|
119次组卷
|
2卷引用:安徽省芜湖市示范高中2020届高三5月联考理综化学试题
名校
解题方法
8 . 有一瓶澄清的溶液,其中可能含H+、 、K+、Al3+、Cu2+、Fe3+、
、K+、Al3+、Cu2+、Fe3+、 、I- 中的一种或几种,取该溶液进行如下实验:
、I- 中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性。
②取部分溶液,加入数滴新制的氯水及少量的CC14,振荡后CC14层显紫色。
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中有白色沉淀生产,后白色沉淀完全消失。
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答:
(1) 在溶液中,肯定存在的离子有_______ ,肯定不存在的离子有______ 。
(2) 不能确定是否存在的离子有______ 。证明它(们)是否存在的实验方法是______ 。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目______ 。
(4)写出步骤④涉及的离子方程式______ 。
 、K+、Al3+、Cu2+、Fe3+、
、K+、Al3+、Cu2+、Fe3+、 、I- 中的一种或几种,取该溶液进行如下实验:
、I- 中的一种或几种,取该溶液进行如下实验:①用pH试纸检验,表明溶液呈强酸性。
②取部分溶液,加入数滴新制的氯水及少量的CC14,振荡后CC14层显紫色。
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中有白色沉淀生产,后白色沉淀完全消失。
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答:
(1) 在溶液中,肯定存在的离子有
(2) 不能确定是否存在的离子有
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目
(4)写出步骤④涉及的离子方程式
您最近一年使用:0次
2020-04-15更新
|
141次组卷
|
2卷引用:河北省沧州市第一中学2019-2020学年高二4月月考化学试题
9 . 为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,取少量硫酸亚铁铵晶体放入试管,下列实验叙述中错误的是
| A.加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.加少量水,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则证明晶体的成分中含有Fe2+ |
| C.加水溶解,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.加浓NaOH溶液,加热,用湿润的蓝色石蕊试纸放在试管口检验,试纸变红色,则证明晶体的成分中含有NH4+ |
您最近一年使用:0次
2019-12-03更新
|
172次组卷
|
3卷引用:福建省2020届高三化学总复习专题训练——硫酸亚铁铵
10 . 下列叙述中正确的是
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
您最近一年使用:0次
2020-03-28更新
|
2139次组卷
|
39卷引用:2012年普通高等学校招生全国统一考试化学(新课标)
2012年普通高等学校招生全国统一考试化学(新课标)(已下线)2013届福建安溪一中、养正中学高三上学期期中联考化学试卷(已下线)2014届贵州省六盘水市六校上学期期末联合统考理综化学试卷2014-2015广东省深圳市高级中学高一下学期期中化学试卷2016届宁夏长庆高级中学高三上学期第三次月考理综化学试卷2016届湖南省师范大学附属中学高三上月考化学试卷2015-2016学年河北省大名一中高二下第二次月考化学试卷2017届江西省九江一中高三上学期第一次月考化学试卷四川省成都七中实验学校2016-2017学年高二下学期期中考试化学试题辽宁省庄河市高级中学2016-2017学年高二下学期期末考试化学试题福建省莆田市第二十五中学2018届高三上学期第二次月考化学试题1黑龙江省哈尔滨市第六中学2017-2018学年高一12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高一12月月考化学试卷福建省莆田第一中学2018届高三上学期第一学段化学试题黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题2019届高三化学一轮复习针对训练:卤族元素及其化合物陕西省西安市远东第一中学2019届高三上学期期中考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期期末考试化学试题(已下线)【走进新高考】(人教版必修一)4.2.2富集在海水中的元素——氯 (氯离子检验和氯气制法) 同步练习01【全国百强校】黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题【区级联考】山东省济南市莱芜区2019届高三第一学期期末质量检测化学试题【校级联考】广东省深圳四校发展联盟体2018-2019学年高一第二学期期中考试化学试题上海中学2017-2018学年高一(上)期中化学试卷2020年春季鲁教版高中化学必修1第3章《自然界中的元素》测试卷江西省景德镇一中2019-2020学年高一上学期期末考试(2班)化学试题山东省2020届高三新高考仿真模拟化学试题(已下线)上海市奉贤区2013年高考二模化学试题湖南省邵东县第一中学2019-2020学年高二下学期期末考试化学试题河南省鹤壁市高级中学2021届高三上学期第一次模拟测试(8月段考)化学试题江西省贵溪市实验中学2020-2021学年高二上学期第一次月考化学试题甘肃省平凉市庄浪县第一中学2021届高三第四次模拟化学试题广东省广州市禺山高级中学2020-2021学年高二下学期第一阶段考试化学试题新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题陕西省榆林市第十二中学2021-2022学年高三上学期班级教学自主质量评估测试化学试题(已下线)卷13 化学基础实验(检验、鉴别、分离、提纯)-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)第10讲 氯及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 离子共存、检验和推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)山东烟台2022-2023学年高一下学期3月月考化学试题



