名校
1 . 硫酸亚铁铵(NH4)2Fe(SO4)2•6H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:(已知:FeS2与H2SO4不反应)
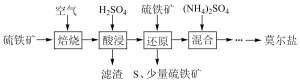
(1)莫尔盐属于____________ 。
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2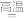 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有__________ ,若150kg硫铁矿(FeS2质量分数为80%)完全反应转移电子数为________________________
(3)加H2SO4酸浸,发生反应的离子方程式为________________________________ 。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:_________________________________ 。
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中, _______________ 证明含有Fe2+和NH4+。

(1)莫尔盐属于
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2
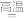 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有(3)加H2SO4酸浸,发生反应的离子方程式为
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于
您最近一年使用:0次
2 . 下列关于物质或离子检验的叙述正确的是
| A.在溶液中加硝酸酸化后再加BaCl2溶液有白色沉淀,证明原溶液中一定有SO42- |
| B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 |
| C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
您最近一年使用:0次
2018-12-17更新
|
63次组卷
|
3卷引用:江西省南康中学2018-2019学年高一上学期第三次月考化学试题
3 . 为检验溶液里的某种离子,进行下列实验,其中结论正确的是
| A.溶液中加AgNO3溶液有白色沉淀生成,再加入稀盐酸沉淀不溶解,溶液一定含Cl- |
| B.先滴加KSCN溶液不显红色,再滴加氯水后显红色证明某溶液中含有Fe2+ |
| C.某溶液进行焰色反应为黄色,则该溶液一定含有Na+,一定没有K+ |
| D.溶液中加入稀HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含CO32- |
您最近一年使用:0次
2019-01-03更新
|
149次组卷
|
2卷引用:【全国百强校】西藏自治区拉萨中学2018-2019学年高一上学期期末考试化学试题
名校
4 . 下列实验方案、现象、得出的结论均正确的是( )
| 选项 | 实验及现象 | 结论 |
| A | 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 | 该样品含钠元素 |
| B | 向NaHCO3溶液中加入过量盐酸振荡、静置、有气泡产生 | 证明非金属性Cl>C |
| C | 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 证明SO2被氧化为SO42- |
| D | 将10mL2mol/L的KI溶液与1mL1mol/LFeCl3溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-08-28更新
|
3203次组卷
|
15卷引用:【全国校级联考】辽宁省六校协作体2019届高三上学期期初联考化学试题
【全国校级联考】辽宁省六校协作体2019届高三上学期期初联考化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题辽宁省抚顺市第十中学2018-2019学年高二下学期期中考试化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题河北省石家庄市行唐县三中2020届高三11月月考化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题甘肃省天水市一中2020届高三上学期第四次考试化学试题内蒙古包钢第一中学2020届高三上学期10月月考化学试题黑龙江省鹤岗市第一中学2021届高三上学期第一次月考(开学考试)化学试题江西省奉新县第一中学2021届高三上学期第二次月考化学试题湖南省邵东县第一中学2021届高三上学期第三次月考化学试题陕西省咸阳市武功县普集高级中学2021-2022学年高三上学期期末考试化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期8月月考化学试题
5 . 下列关于物质或离子检验的叙述正确的是
| A.在溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀,证明原溶液中有SO42- |
| B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,证明该溶液一定是钠盐溶液 |
| C.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是SO2 |
您最近一年使用:0次
2018-06-03更新
|
581次组卷
|
9卷引用:浙江省余姚中学2018届高三选考科目模拟卷(一)化学
6 . 下列关于物质或离子检验的叙述正确的是
| A.往品红溶液中通入气体,红色褪去,证明气体一定是二氧化硫 |
| B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 |
| C.加入氯化钡溶液生成沉淀,再加入盐酸沉淀不溶解证明一定含有硫酸根 |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
您最近一年使用:0次
2018-03-13更新
|
268次组卷
|
7卷引用:河南省中原名校(即豫南九校)2017-2018学年高一下学期第一次联考化学试题1
7 . 下列关于物质或离子检验的叙述正确的是( )
| A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ |
| B.在溶液中先加盐酸无现象,再加BaCl2溶液,产生白色沉淀,证明原溶液中含SO42- |
| C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ |
| D.某气体可使湿润的淀粉KI试纸变蓝,证明该气体是Cl2 |
您最近一年使用:0次
2017-10-14更新
|
100次组卷
|
2卷引用:江西省南昌市第二中学2018届高三上学期第三次月考化学试题
名校
解题方法
8 . 根据铁及其化合物的性质,回答下列问题:
(1)除去铜粉中混有的铁粉,可选用的试剂为_____________________ 。
A.FeCl3溶液 B.H2SO4溶液 C.CuSO4溶液 D.NaOH溶液
(2)为了检验某未知溶液是否是FeCl2溶液,一位同学设计了以下实验方案加以证明。
方案:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液,回答以下问题:你认为此方案是否合理________ (填“合理”或“不合理”),若不合理,要检验Fe2+应如何操作?_________ (若填“合理”,则此空不答)。
(3)现向一支装有FeCl2溶液的试管中滴加氢氧化钠溶液,可观察到的现象是__________________ ,有关的化学方程式为__________________ 。
(4)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用离子方程式表示)___________________ 。
(1)除去铜粉中混有的铁粉,可选用的试剂为
A.FeCl3溶液 B.H2SO4溶液 C.CuSO4溶液 D.NaOH溶液
(2)为了检验某未知溶液是否是FeCl2溶液,一位同学设计了以下实验方案加以证明。
方案:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液,回答以下问题:你认为此方案是否合理
(3)现向一支装有FeCl2溶液的试管中滴加氢氧化钠溶液,可观察到的现象是
(4)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用离子方程式表示)
您最近一年使用:0次
2017-04-25更新
|
357次组卷
|
3卷引用:山东省寿光现代中学2016-2017学年高一下学期第三学段质量监测(期中)化学试题
9 . 某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如下实验:
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(1)①中的白色沉淀是___________________ 。
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化____________________________ 。
(3)②中可能发生的离子反应有_________________ 。
(4)实验①的设计目的_______________________ 。
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为_________________ 。
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验:
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变。
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如下实验:
现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化。
丙同学的设计在证明氧化还原反应的优点是___________________________ 。
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是______ 。

已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(1)①中的白色沉淀是
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化
(3)②中可能发生的离子反应有
(4)实验①的设计目的
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验:
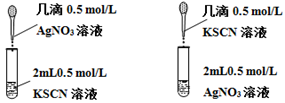
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变。
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如下实验:

现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化。
丙同学的设计在证明氧化还原反应的优点是
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是
您最近一年使用:0次
名校
10 . 某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________ 。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________ ,用离子方程式解释产生其原因:_______ 。
(2)氯气和FeBr2反应实验操作及现象如下:
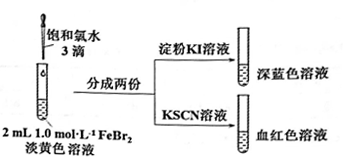
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________ 。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________ 。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________ 。
(3)丙同学继续设计实验,探究反应过程:
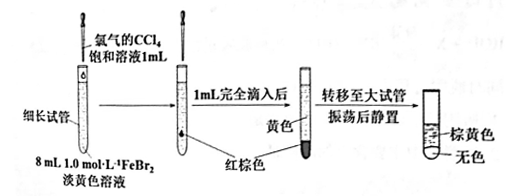
①转移到大试管前CCl4液体中呈红棕色的物质是___________ 。
②丙通过此实验可得出结论:________ 。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是
②丙通过此实验可得出结论:
您最近一年使用:0次
2017-03-15更新
|
785次组卷
|
4卷引用:2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷
2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷2020届高考化学二轮复习大题精准训练——反应原理(历程)的探究式实验(已下线)专题6.2 实验综合题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升北京市中央民族大学附属中学2022届高三9月月考化学试题



