名校
解题方法
1 . 环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:

已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
(1)如需配制480mL酸浸环节所需的硫酸,需要用量筒量取18.4mol·L-1的浓硫酸__________ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器:__________ 。
(2)经氧化环节滤液I中的Cr3+转化为Cr2O ,写出此反应的离子方程式:
,写出此反应的离子方程式:__________ 。
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因__________ 。
(4)钠离子交换树脂的反应原理为Mn++nNaR⇌MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________ 。
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:__________ 。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN—的浓度,可用标准AgNO3溶液滴定待测液,已知:
滴定时可选为滴定指示剂的是_____ (填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
如何确定该滴定过程的终点:__________ 。

已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Mg2+ | Аl3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
| 沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(1)如需配制480mL酸浸环节所需的硫酸,需要用量筒量取18.4mol·L-1的浓硫酸
(2)经氧化环节滤液I中的Cr3+转化为Cr2O
 ,写出此反应的离子方程式:
,写出此反应的离子方程式:(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O
 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因(4)钠离子交换树脂的反应原理为Mn++nNaR⇌MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN—的浓度,可用标准AgNO3溶液滴定待测液,已知:
| 银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 黄 | 白 | 砖红 | 白 |
| Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是
A.NaCl B.K2CrO4 C.KI D.NaCN
如何确定该滴定过程的终点:
您最近一年使用:0次
2021-07-14更新
|
506次组卷
|
5卷引用:2021年河北省高考化学试卷变式题10-18题
2 . 五水合硫酸铜(CuSO4·5H2O)是蓝色晶体,某学生实验小组利用铜屑制备CuSO4·5H2O,并进行了相关实验。具体合成路线如下:

回答下列问题:
(1)铜屑需经预处理除去表面油污,方法是___________ 。
(2)步骤①的实验装置如图(a)所示(夹持、加热仪器略),其中浓硝酸需要逐滴加入,其原因是___________ 。(写出两点即可)
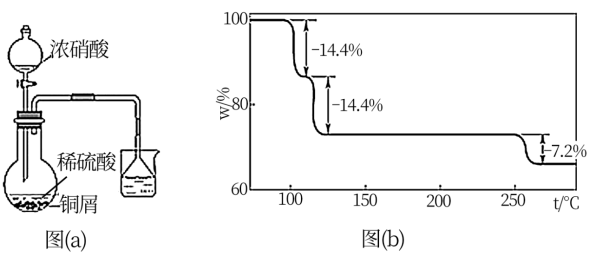
(3)CuSO4·5H2O在受热时质量分数(w)随温度的变化情况如图(b)所示。据此分析可知,CuSO4·5H2O受热过程可能发生的化学反应是___________ (填标号)。
A.

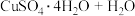
B.

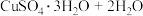
C.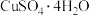

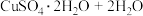
D.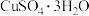


(4)制备过程中若加热不当会导致晶体发白,为了得到蓝色的CuSO4·5H2O晶体,步骤③最适宜采用___________ (填标号)加热。
A. 电热套B.
电热套B. 酒精灯C.
酒精灯C. 水浴锅 D.煤气灯
水浴锅 D.煤气灯
(5)CuSO4·5H2O保存不当会失水风化,为测定所得产品中结晶水的含量,学生小组进行了如下实验:
①准确称取产品(CuSO4·xH2O)mg置于250mL锥形瓶中,用适量水溶解,加入足量KI,得到白色沉淀和I2的棕黄色溶液,相应的离子方程式为___________ 。
②以淀粉为指示剂,用浓度为cmol·L-1的Na2S2O3标准溶液滴定上述反应中生成的I2,滴定终点时的颜色变化为___________ 。
③滴定达终点时消耗Na2S2O3溶液VmL,则x=___________ (列表达式)。
(已知:滴定反应的离子方程式为: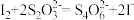 )
)
(6)请从原子经济性和环境友好的角度,设计由铜制备CuSO4·5H2O的合成路线___________ 。

回答下列问题:
(1)铜屑需经预处理除去表面油污,方法是
(2)步骤①的实验装置如图(a)所示(夹持、加热仪器略),其中浓硝酸需要逐滴加入,其原因是

(3)CuSO4·5H2O在受热时质量分数(w)随温度的变化情况如图(b)所示。据此分析可知,CuSO4·5H2O受热过程可能发生的化学反应是
A.


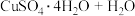
B.


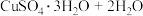
C.
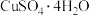

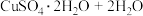
D.
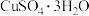


(4)制备过程中若加热不当会导致晶体发白,为了得到蓝色的CuSO4·5H2O晶体,步骤③最适宜采用
A.
 电热套B.
电热套B. 酒精灯C.
酒精灯C. 水浴锅 D.煤气灯
水浴锅 D.煤气灯
(5)CuSO4·5H2O保存不当会失水风化,为测定所得产品中结晶水的含量,学生小组进行了如下实验:
①准确称取产品(CuSO4·xH2O)mg置于250mL锥形瓶中,用适量水溶解,加入足量KI,得到白色沉淀和I2的棕黄色溶液,相应的离子方程式为
②以淀粉为指示剂,用浓度为cmol·L-1的Na2S2O3标准溶液滴定上述反应中生成的I2,滴定终点时的颜色变化为
③滴定达终点时消耗Na2S2O3溶液VmL,则x=
(已知:滴定反应的离子方程式为:
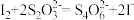 )
)(6)请从原子经济性和环境友好的角度,设计由铜制备CuSO4·5H2O的合成路线
您最近一年使用:0次
3 .  是制备铁催化剂的主要原料,某化学小组利用莫尔盐
是制备铁催化剂的主要原料,某化学小组利用莫尔盐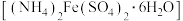 制备
制备 的实验流程如下:
的实验流程如下:
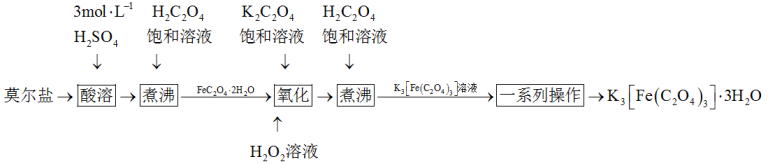
已知:氧化操作中 除生成
除生成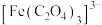 外,另一部分铁元素转化为红褐色沉淀。
外,另一部分铁元素转化为红褐色沉淀。
(1)“酸溶”时,莫尔盐_______ (填“能”或“不能”)用 的
的 溶解,原因是
溶解,原因是_______ 。
(2)第一次“煮沸”时,生成 的离子方程式为
的离子方程式为_______ 。
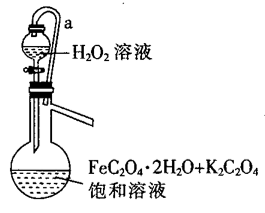
(3)“氧化”时所用的实验装置如图所示(夹持装置略去),导管a的作用是_______ ;“氧化”时反应液应保持温度在40℃左右,则适宜的加热方式为_______ (填“直接加热”或“水浴加热”)。
(4)测定产品中铁的含量。
步骤ⅰ:称量mg样品,加水溶解,加入稀硫酸,再滴入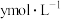 的
的 溶液使其恰好反应完全。
溶液使其恰好反应完全。
步骤ⅱ:向步骤ⅰ所得的溶液中加入过量 粉,反应完全后,滤去不溶物,向溶液中滴入酸化的
粉,反应完全后,滤去不溶物,向溶液中滴入酸化的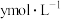 的
的 溶液,滴定至终点,消耗
溶液,滴定至终点,消耗 溶液zmL。
溶液zmL。
①步骤ⅰ中,若加入的 溶液过量,则所测的铁元素的含量
溶液过量,则所测的铁元素的含量_______ (填“偏大”、“偏小”或“不变”,下同),若步骤ⅱ中不滤去不溶物,则所测的铁元素的含量_______ 。
②该样品中铁元素的质量分数为_______ (用含m、y、z的代数式表示)。
 是制备铁催化剂的主要原料,某化学小组利用莫尔盐
是制备铁催化剂的主要原料,某化学小组利用莫尔盐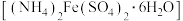 制备
制备 的实验流程如下:
的实验流程如下:
已知:氧化操作中
 除生成
除生成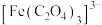 外,另一部分铁元素转化为红褐色沉淀。
外,另一部分铁元素转化为红褐色沉淀。(1)“酸溶”时,莫尔盐
 的
的 溶解,原因是
溶解,原因是(2)第一次“煮沸”时,生成
 的离子方程式为
的离子方程式为(3)“氧化”时所用的实验装置如图所示(夹持装置略去),导管a的作用是

(4)测定产品中铁的含量。
步骤ⅰ:称量mg样品,加水溶解,加入稀硫酸,再滴入
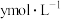 的
的 溶液使其恰好反应完全。
溶液使其恰好反应完全。步骤ⅱ:向步骤ⅰ所得的溶液中加入过量
 粉,反应完全后,滤去不溶物,向溶液中滴入酸化的
粉,反应完全后,滤去不溶物,向溶液中滴入酸化的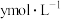 的
的 溶液,滴定至终点,消耗
溶液,滴定至终点,消耗 溶液zmL。
溶液zmL。①步骤ⅰ中,若加入的
 溶液过量,则所测的铁元素的含量
溶液过量,则所测的铁元素的含量②该样品中铁元素的质量分数为
您最近一年使用:0次
2013·河北保定·一模
解题方法
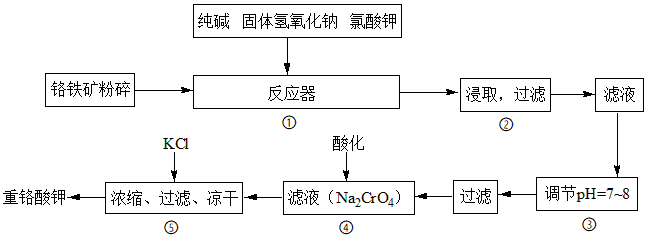
4 . 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_____ 。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:___ 。
(3)简要叙述操作③的目的:_______ 。
(4)操作④中,酸化时,CrO 转化为Cr2O
转化为Cr2O ,写出平衡转化的离子方程式:
,写出平衡转化的离子方程式:_______ 。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O =2I-+S4O
=2I-+S4O ),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度
),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度_______ (设整个过程中其它杂质不参与反应)。
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
(3)简要叙述操作③的目的:
(4)操作④中,酸化时,CrO
 转化为Cr2O
转化为Cr2O ,写出平衡转化的离子方程式:
,写出平衡转化的离子方程式:(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O
 =2I-+S4O
=2I-+S4O ),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度
),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度
您最近一年使用:0次



